Cercetătorii au descoperit că infecţia cu un virus comun, care poate fi transmis de la mamă la făt înainte de naştere, agravează în mod semnificativ o complicaţie adesea fatală a naşterii premature numită enterocolită necrozantă (NEC), o afecţiune relativ rară, dar încă cea mai frecventă complicaţie intestinală de urgenţă la prematuri.
Până la aproape 10% dintre copiii născuţi prematur dezvoltă NEC, o boală caracterizată printr-o inflamaţie severă a mucoasei intestinale care, în cele din urmă, omoară acest ţesut.
Aproximativ o treime dintre copiii cu NEC mor în cele din urmă din această cauză, iar ratele de supravieţuire au rămas neschimbate în ultimele trei decenii.
Acum, o echipă de cercetare de la Centrul pediatric Johns Hopkins a făcut noi descoperiri care avansează căutarea unor tratamente mai eficiente pentru NEC.
Un raport privind studiul a fost publicat pe 13 februarie în revista Cellular and Molecular Gastroenterology and Hepatology.
„NEC este cea mai importantă boală de care majoritatea oamenilor nu au auzit probabil niciodată. Impactul acestei boli asupra copiilor prematuri şi a familiilor lor este mare şi este înrăutăţit de faptul că populaţiai aude adesea despre NEC, pentru prima dată, abia după ce persoana lor dragă este diagnosticată cu această afecţiune. În mod surprinzător, de multe ori nu ştim care sunt cauzele NEC în primul rând. Prin identificarea legăturii sale cu infecţia cu citomegalovirus (CMV), am identificat acum un factor declanşator important pentru NEC, care ar putea salva vieţile copiilor prematuri care dezvoltă această afecţiune”, a declarat luni, într-un comunicat, dr. David Hackam, chirurg şef şi director adjunct al centrului pediatric Johns Hopkins.
Cercetări recente pe animale, spune dr. Hackam, au arătat că inflamaţia caracteristică NEC se datorează, cel puţin parţial, unei creşteri persistente a unei proteine imunitare numite receptor Toll-like 4 (TLR4), care devine activată de acumularea anormală de bacterii intestinale specifice care tind să se dezvolte excesiv în tractul digestiv al copiilor născuţi prematur, ceea ce a indicat CMV ca suspect principal. Motivul pentru care NEC este mai severă la unii copii şi tinde să se răspândească a rămas însă un mister.
Se estimează că între 40% şi 80% dintre persoanele din întreaga lume sunt infectate cronic cu citomegalovirus, un virus din familia herpesului care, de obicei, nu provoacă simptome la persoanele sănătoase, dar este o cauză frecventă a pierderii auzului şi a altor malformaţii congenitale dăunătoare organelor atunci când este transmis de la mamă la făt în timpul sarcinii.
Fetuşii dobândesc CMV de la mamele infectate în timpul gestaţiei în proporţie de 30-50% din cazuri.
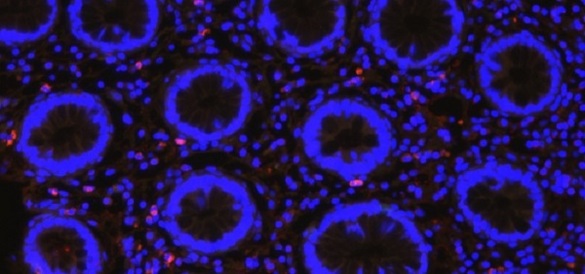
Imagine de microscopie confocală care arată infecţia cu CMV (puncte roşii) în intestinul sugarului (nuclee în albastru). Credit: Cody Tragesser şi William Fulton, Universitatea Johns Hopkins, 24 februarie 2025.
Suspectând o legătură între CMV şi severitatea NEC, dr. Hackam şi colegii săi au dezvoltat un model de şoarece neonatal de NEC cu CMV. Atunci când au comparat intestinele rozătoarelor cu şi fără infecţie cu CMV, au constatat că şoarecii purtători de CMV prezentau leziuni ale ţesuturilor semnificativ mai grave şi rate de mortalitate mai ridicate comparativ cu cei fără acest virus.
Căutând un mecanism molecular pentru acest rezultat, cercetătorii au comparat activitatea genelor din intestinele celor două grupuri de şoareci. Ei au constatat că infecţia cu CMV a declanşat căi genetice care au încurajat inflamaţia, au perturbat metabolismul şi au determinat celulele să producă mai mult TLR4.
O privire mai atentă a arătat că CMV a deteriorat, de asemenea, mitocondriile, organite care servesc drept fabrici de energie ale celulelor. Deteriorarea cauzată de infecţia cu CMV a scăzut semnificativ producţia mitocondrială de adenozin trifosfat (ATP), o moleculă pe care celulele o folosesc drept combustibil.
Experimente ulterioare cu ţesut de şoarece, a remarcat dr. Hackam, au arătat că TLR4 era necesar pentru fiecare dintre aceste efecte. Şoarecii modificaţi genetic pentru a nu produce TLR4 în intestine, de exemplu, au prezentat o severitate semnificativ mai scăzută a NEC chiar şi în cazul infecţiei cu CMV, ceea ce sugerează că această proteină ar putea fi o ţintă bună pentru dezvoltarea de medicamente împotriva NEC.
În cazul în care studiile pe animale şi pe oameni confirmă legătura CMV-NEC, o altă opţiune de tratament ar putea fi administrarea de adenozină, explică medicul, un precursor al ATP care este vândut în mod obişnuit ca supliment alimentar. Atunci când cercetătorii au administrat adenozină şoarecilor cu NEC şi CMV, aceasta a redus semnificativ severitatea NEC. Echipa intenţionează să investigheze aceste descoperiri în studii viitoare.





