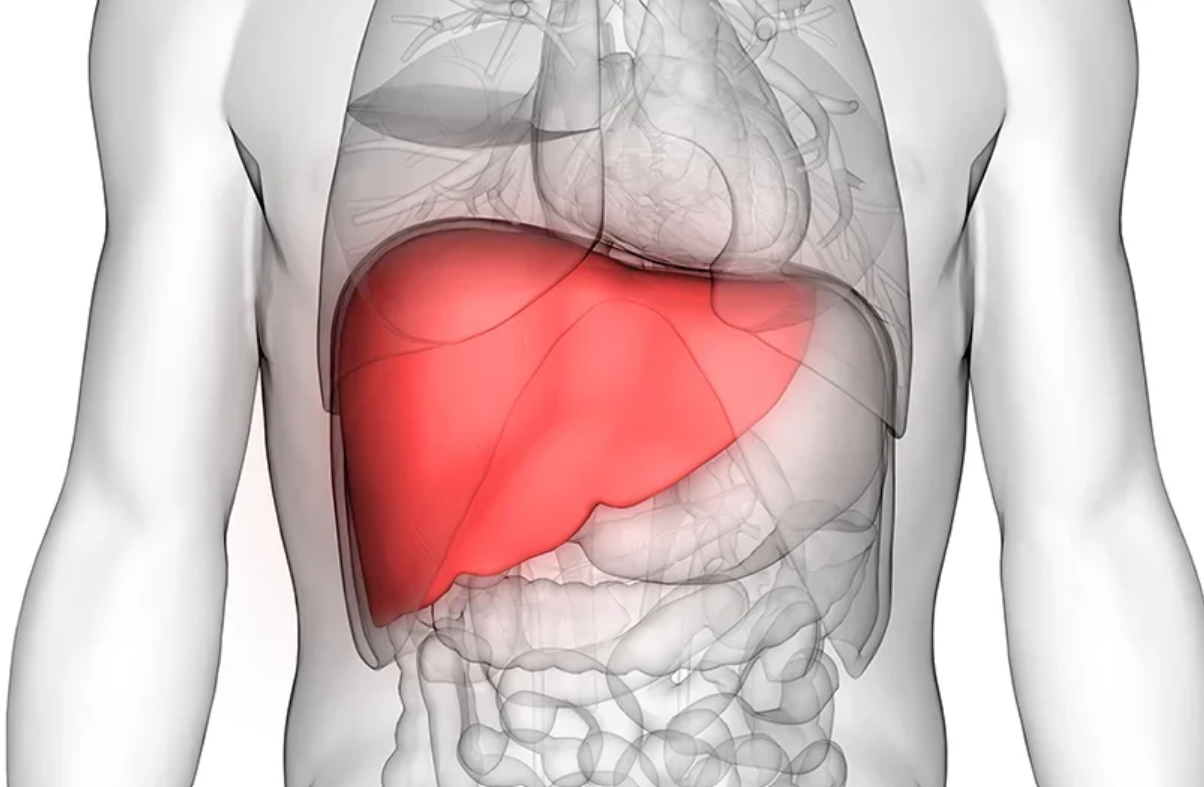
Aşteptarea de zeci de ani pentru un tratament eficient pentru steatohepatita asociată disfuncţiei metabolice (MASH) a luat sfârşit, întrucât Administraţia americană pentru alimente şi medicamente (FDA) a aprobat joi primul medicament pentru această boală a ficatului gras. Steatohepatita asociată disfuncţiei metabolice (MASH – cunoscută anterior sub numele de steatohepatită non-alcoolică – NASH, sau boala ficatului gras non-alcoolic – BFGNA) este una dintre principalele cauze de boli hepatice la nivel mondial. Potrivit studiilor, incidenţa globală estimată a BFGNA este de 47 de cazuri la 1.000 de locuitori şi este mai mare la bărbaţi (40%) în comparaţie cu femeile (26%). Cei mai mulţi dintre aceşti pacienţi vor ajunge la cicatrizarea severă a ficatului (fibroză hepatică severă/ciroză).
FDA din Statele Unite a autorizat primul tratament pentru o boală a ficatului gras cunoscută sub numele de steatohepatita asociată disfuncţiei metabolice (MASH), cunoscută anterior şi sub numele de steatohepatită non-alcoolică (NASH).
După un parcurs lung în domeniul dezvoltării unui tratament pentru această boală comună, medicamentul resmetirom de la producătorul farmaceutic american, Madrigal Pharmaceuticals, a devenit prima terapie MASH autorizată.
Joi, FDA a aprobat medicamentul sub formă de tablete pentru tratamentul MASH, cu cicatrizare hepatică moderată sau severă (fibroză), în concordanţă cu stadiul F2 şi F3 al bolii, conform etichetei produsului (PDF) postată pe site-ul web al FDA.
Afecţiunea, care a fost recent redenumită ca steatohepatită asociată disfuncţiei metabolice (MASH), în loc de steatohepatită non-alcoolică (NASH), afectează aproximativ 1,5 milioane de persoane în Statele Unite, potrivit estimărilor companiei, şi până acum nu a existat niciun tratament aprobat pentru această afecţiune comună.
Autorizarea prin procedură accelerată a medicamentului s-a bazat pe datele unui studiu în stadiu avansat efectuat pe 888 de pacienţi, care a arătat că cei care au luat medicamentul au avut o rezolvare semnificativă a simptomelor sau o îmbunătăţire a cicatricilor hepatice în comparaţie cu cei care au luat placebo, potrivit FDA.
Medicamentul cu administrare pe cale orală va fi disponibil sub numele de marcă Rezdiffra începând cu luna aprilie, a declarat directorul general al companiei, Bill Sibold, pentru Reuters înainte de aprobare.
Medicamentul a fost autorizat pentru pacienţii care au MASH cu fibroză hepatică (cicatrizare a ficatului), care a progresat până la stadiul 2 sau 3 de severitate, a declarat joi compania într-un comunicat, anunţând că a stabilit preţul medicamentului en-gros anual de 47.400 la dolari.
Cauza apariţiei MASH nu este pe deplin cunoscută. Afecţiunea este de obicei asociată cu obezitatea, hipotiroidismul, diabetul, niveluri ridicate de grăsimi în sânge şi probleme de sănătate similare, care determină acumularea excesivă de grăsime în ficat şi provoacă inflamaţie şi fibroză, sau cicatrizarea organului.
Producători din industria farmaceutică precum Akero Therapeutics, 89bio, Viking Therapeutics şi Sagimet Biosciences desfăşoară studii în stadii medii şi avansate cu medicamente pentru această afecţiune comună a ficatului.
Se estimează că peste 115 milioane de adulţi din întreaga lume sunt afectaţi.