O terapie genică experimentală pentru o boală neurodegenerativă rară, care debutează în copilăria timpurie, cunoscută sub numele de neuropatie axonală gigantică (GAN), a fost bine tolerată şi a prezentat semne de beneficii terapeutice într-un studiu clinic condus de Institutele naţionale americane de Sănătate (NIH).
În prezent, nu există niciun tratament eficient pentru GAN, iar boala este de obicei fatală până la vârsta de 30 de ani.
Paisprezece copii cu GAN, cu vârste cuprinse între 6 şi 14 ani, au fost trataţi cu terapia prin transfer de gene la Centrul Clinic al NIH şi apoi au fost urmăriţi timp de aproximativ şase ani pentru a evalua siguranţa.
Rezultatele studiului clinic în fază incipientă sunt publicate joi, în New England Journal of Medicine - NEJM.
Terapia genică utilizează un virus modificat pentru a livra copii funcţionale ale genei defecte GAN în celulele nervoase din organism.
Este pentru prima dată când o terapie genică a fost administrată direct în lichidul spinal, ceea ce îi permite să vizeze neuronii motori şi senzoriali afectaţi în GAN.
La anumite niveluri de doză, tratamentul a părut să încetinească rata de declin al funcţiei motorii.
Rezultatele studiului reprezintă un prim indiciu că terapia ar putea avea o siguranţă şi o tolerabilitate favorabile şi ar putea ajuta persoanele cu această boală cu evoluţie rapidă.
De asemenea, rezultatele sugerează că regenerarea nervilor senzoriali ar putea fi posibilă la unii pacienţi.
„O constatare neaşteptată a studiului a fost faptul că nervii senzoriali, care sunt afectaţi cel mai devreme în GAN, au început să se 'trezească' din nou la unii dintre pacienţi", a declarat într-un comunicat Carsten G. Bonnemann, doctor în medicină, autor principal şi şef al secţiei de tulburări pediatrice neuromusculare şi neurogenetice din cadrul Institutului Naţional pentru Tulburări Neurologice şi Accidente Vasculare Cerebrale (NINDS), parte a NIH.
„Cred că marchează prima dată când s-a demonstrat că un nerv senzitiv afectat într-o boală genetică degenerativă poate fi salvat efectiv cu o astfel de terapie genică", a precizat acesta.
Participanţii la acest studiu, „primul la om", care a început în 2015, au primit o singură doză de terapie genică, numită scAAV9/JeT-GAN, printr-o injecţie în lichidul din jurul coloanei vertebrale.
Primii doi pacienţi au primit cea mai mică doză de transfer de gene, care a fost crescută la pacienţii următori.
Pe parcursul studiului au fost testate patru niveluri dozaj, care au fost estimate pe baza rezultatelor obţinute în urma studiilor pe modele animale.
Doar un singur eveniment advers grav - o febră - a fost potenţial legat de terapia genică.
Tratamentul a dus la 129 de evenimente adverse conexe de gravitate mai mică, inclusiv dureri de cap, dureri de spate, ritm cardiac neregulat şi inflamaţie în lichidul spinal care a fost tratată cu corticosteroizi.
Doi pacienţi care erau mai în vârstă şi care au primit cea mai mică doză de terapie au murit în timpul perioadei de studiu din cauza unor evenimente legate de boala lor de bază.
Pe lângă siguranţă, dr. Bonnemann şi echipa sa au evaluat, de asemenea, scorurile funcţiei motorii şi testele funcţiei nervoase în rândul participanţilor la studiu.
Odată cu creşterea nivelurilor dozei, cercetătorii au constatat că probabilitatea oricărei încetiniri a declinului motor a fost de 44%, 92%, 99% şi, respectiv, 90%.
Pe măsură ce GAN progresează, nivelurile electrice ale nervilor senzoriali scad şi, în cele din urmă, dispar.
Cu ajutorul terapiei genice, 6 din 14 pacienţi şi-au recăpătat răspunsul nervilor senzoriali după tratament - măsurile electrice au crescut, au încetat să mai scadă sau au devenit măsurabile după ce fuseseră absente.
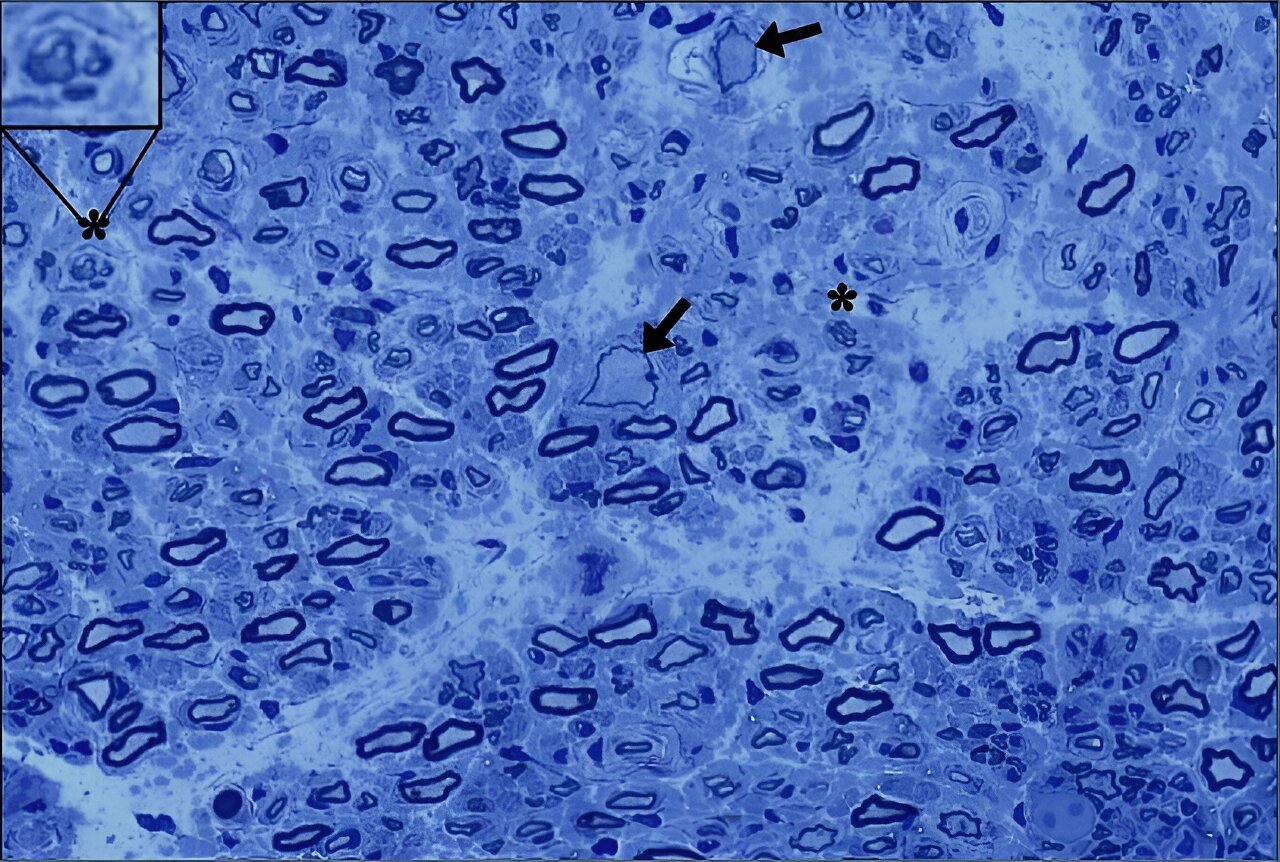 Biopsie a unui nerv senzorial de la un participant la studiul de terapie genică GAN (săgeţile indică axoni giganţi; grup de nervi în regenerare în partea superioară stângă). Unii pacienţi şi-au recăpătat răspunsul nervos senzorial după tratament. Credit: Laboratorul Bonnemann/NINDS
Biopsie a unui nerv senzorial de la un participant la studiul de terapie genică GAN (săgeţile indică axoni giganţi; grup de nervi în regenerare în partea superioară stângă). Unii pacienţi şi-au recăpătat răspunsul nervos senzorial după tratament. Credit: Laboratorul Bonnemann/NINDS
Mutaţiile la gena GAN au ca rezultat incapacitatea de a descompune filamentele intermediare, care sunt structuri celulare ce alcătuiesc cadrul extensiilor celulelor nervoase numite axoni. Axonii sunt esenţiali pentru transmiterea semnalelor între celulele cerebrale. Numele bolii se referă la aspectul mărit şi umflat al axonului la microscop.
Pe măsură ce GAN progresează, axonii nervilor motori şi senzoriali se rup, ceea ce duce la dificultăţi de mişcare şi senzaţie, deoarece celulele nervoase nu pot comunica între ele.
Primele simptome ale GAN sunt adesea un mers stângaci şi instabil, devenind evidente încă de la vârsta de 2 sau 3 ani.
Boala progresează astfel încât, până la vârsta de 8 sau 9 ani, pacienţii au nevoie, de obicei, de utilizarea unui scaun cu rotile, urmată de o utilizare din ce în ce mai limitată a braţelor şi de o utilizare redusă sau inexistentă a picioarelor.
În ultimele etape, persoanele cu GAN au adesea nevoie de asistenţă respiratorie şi de un tub de hrănire.
De acest studiu ar putea beneficia, de asemenea, terapia genică pentru alte boli.
Cercetătorii care testează alte terapii genice au adoptat deja administrarea directă în lichidul spinal, care necesită doze mai mici în comparaţie cu administrarea obişnuită în sânge prin venă.
Injectarea în lichidul spinal reduce, de asemenea, probabilitatea unui răspuns imunitar, ceea ce permite pacienţilor care au dezvoltat imunitate la virusul adeno-asociat (VAA), virusul comun utilizat ca sistem de livrare a genelor în cadrul terapiei, să primească potenţial tratamentul.
Copiii purtători de anticorpi la VAA în urma expunerii naturale la virus au fost excluşi de la terapia genică din cauza reacţiei lor imune.
Oamenii de ştiinţă vor continua să evalueze terapia scAAV9/JeT-GAN pentru a perfecţiona tratamentul.
În continuare, cercetătorii plănuiesc să testeze dacă transferul de gene GAN este mai eficient atunci când este administrat la copiii mai mici sau la cei aflaţi într-un stadiu mai timpuriu al bolii.
Următoarea fază a studiului va contribui la determinarea mai amănunţită a siguranţei şi eficacităţii sale.






