De milenii, oamenii au încercat să-şi mărească durata de viaţă cât mai mult posibil. Am încercat congelarea, postul alimentar şi remediile pe bază de plante. Milioane de dolari se îndreaptă către companii din întreaga lume care caută să prelungească durata de viaţă a oamenilor.
Recent, miliardari precum Larry Page (co-fondatorul Google), Mark Zuckerberg şi Jeff Bezos au investit sume importante în companii de biotehnologie precum Altos Labs, Juvenescence şi Unity Biotechnology, care urmăresc căutarea longevităţii prin întinerirea celulelor şi prevenirea bolilor.
Până în prezent, cea mai lungă perioadă de viaţă pentru o persoană, potrivit rapoartelor neoficiale a fost de 122 de ani, sau 118 ani, potrivit celor oficiale, dar specialiştii spun că am putea fi capabili să trăim mai mult de atât.
Experţii cred că este posibil ca oamenii să aibă o limită de viaţă de 150 de ani
Chiar dacă am trăi într-o bulă fără boli sau pericole, corpul nostru ar continua să sufere uzură în timp ce pompează sângele, digeră alimentele şi îndeplineşte toate funcţiile necesare supravieţuirii.
Cu cât îmbătrânim, cu atât ar fi nevoie de mai mult timp pentru ca organismul să îşi „revină" după această uzură, deoarece îmbătrânirea este încorporată în celulele şi ADN-ul uman.
Asta înseamnă că ţesuturile îşi pierd treptat capacitatea de a se vindeca singure, ceea ce poate duce la boli şi disfuncţii.
Un studiu sugerează că timpul de recuperare al corpului uman se dublează la fiecare 15 ani.
Astfel, o vânătaie care a avut nevoie de o săptămână pentru a se vindeca la vârsta de 40 de ani ar putea dura două săptămâni la 55 de ani.
În cele din urmă, corpul uman îşi pierde toată capacitatea de rezistenţă, astfel încât orice oase sau ţesuturi care se rup rămân aşa şi nu se mai pot regenera.
Odată ce prea multe părţi ale corpului funcţionează defectuos, se produce decesul.
Cercetătorii nu sunt neapărat de acord asupra limitei maxime pentru momentul în care se întâmplă acest lucru. Unii au propus 115 ani, alţii 130 de ani.
Unul dintre cele mai recente studii, care a analizat peste o jumătate de milion de persoane din Statele Unite şi Marea Britanie, a sugerat că oamenii îşi pierd toată rezistenţa undeva între 120-150 de ani.
Marea întrebare devine: Ce s-ar întâmpla dacă am putea încetini această uzură sau, mai bine zis, dacă am putea să o prevenim cu totul?
Unii experţi susţin că, datorită progreselor medicale, durata medie de viaţă a oamenilor nu are o limită naturală.
Dacă ar fi să aruncăm o privire asupra îmbătrânirii la nivel celular, asupra a ceea ce ne împiedică să trăim mai mult şi asupra grupurilor de cercetători care caută să înţeleagă şi, eventual, să inverseze procesul de îmbătrânire am vedea că:
Senescenţa celulară este unul dintre cele mai cercetate subiecte în privinţa îmbătrânirii umane
Senescenţa celulară este momentul în care o celulă încetează să se mai reproducă, dar nu moare.
Când se întâmplă acest lucru, unele celule senescente se transformă în celule zombi distructive, plutind prin corp şi eliberând substanţe chimice inflamatorii care dăunează celulelor sănătoase, inclusiv celulelor stem, considerate „reparatorii" organismului uman, care ajută la înlocuirea ţesuturilor deteriorate sau rupte.
Însă nu toate celulele senescente sunt rele.
Unele celule senescente secretă substanţe chimice care ajută la repararea rănilor, spune Paul Robbins, director asociat al Institutului pentru Biologia Îmbătrânirii şi Metabolism şi al echipei de descoperiri medicale privind biologia îmbătrânirii, din cadrul universităţii din Minnesota, Statele Unite.
Companii precum Life Biosciences şi Unity Biotechnology dezvoltă în prezent medicamente numite senolitice pentru a viza şi distruge doar celulele senescente „rele" din organism.
Oamenii de ştiinţă spun că, uele medicamente experimentale ar putea chiar să împiedice celulele să devină senescente.
Dar, până în prezent, nimeni nu şi-a dat seama cum să prevină sau să elimine complet celulele senescente dăunătoare.
Până la vârsta de 60 de ani, organismul uman, în special sistemul imunitar, elimină mai greu celulele senescente dăunătoare, ceea ce poate duce la o acumulare care declanşează deteriorarea şi defectarea ţesuturilor, spune Robbins.
O cauză majoră a senescenţei celulare este deteriorarea ADN-ului, ceea ce a contribuit la declanşarea unui alt domeniu de cercetare care a dus la acordarea unui premiu Nobel în 2009: telomerii.
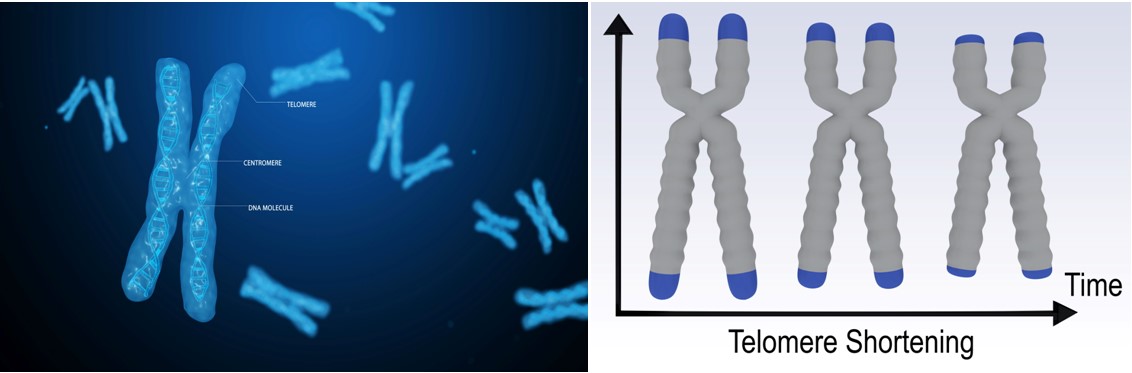 (Foto: Locul telomerilor pe un cromozom în cadrul unei celule. Telomerii ne protejează ADN-ul împotriva deteriorării, ceea ce poate duce la efectele îmbătrânirii. Însă, în timp, aceştia îşi pierd abilităţile de protecţie).
(Foto: Locul telomerilor pe un cromozom în cadrul unei celule. Telomerii ne protejează ADN-ul împotriva deteriorării, ceea ce poate duce la efectele îmbătrânirii. Însă, în timp, aceştia îşi pierd abilităţile de protecţie).
Telomerii ajută la estimarea vârstei biologice
Unii cercetători susţin că vârsta biologică, respectiv, cât de bătrâne sunt celulele şi ţesuturile din organismul uman, este un predictor mai bun al duratei de viaţă decât vârsta cronologică, sau câţi ani a trăit un individ.
Un mod obişnuit prin care oamenii de ştiinţă estimează vârsta biologică este acela de a măsura telomerii din anumite celule imunitare.
Telomerii sunt capacele de protecţie de la capătul ADN-ului uman. Sunt alcătuite din şiruri de molecule numite perechi de baze. Pe măsură ce îmbătrânimi, aceste perechi de baze dispar, scurtând telomerii. Iar telomerii mai scurţi fac ca ADN-ul să fie mai vulnerabil la deteriorări şi la efectele îmbătrânirii.
Când ne naştem, telomerii din anumite celule imunitare, numite leucocite, pot avea între 7.000 şi 11.600 de perechi de baze. Odată ce această dimensiune se micşorează la 5.000 de perechi de baze, există un risc ridicat de deces iminent, a constatat un studiu recent.
Dar alte cercetări au descoperit că unii oameni care trăiesc peste 100 de ani au de fapt telomeri care nu se scurtează ci se lungesc în fiecare an.
Acest lucru i-a determinat pe unii oameni de ştiinţă să cerceteze modalităţi de a imita acest proces de recuperare a telomerilor la persoanele mai tinere.
De exemplu, Aviv Clinics a efectuat un studiu care a examinat modul în care 35 de adulţi în vârstă au răspuns la terapia cu oxigen hiperbaric (HBOT), în care praticipanţii s-au odihnit într-o cameră cu presiune ridicată a aerului şi niveluri ridicate de oxigen. Aceştia au reuşit să crească lungimea telomerilor în celulele leucocitare ale participanţilor după 30 de sesiuni zilnice de HBOT.
Însă majoritatea telomerilor au încetat să crească după cea de-a 30-a şedinţă, iar oamenii de ştiinţă nu ştiu încă cât ar putea dura efectele tratamentului.
Metilarea ADN-ului, legată de mai multe boli asociate cu îmbătrânirea
Un alt factor care contribuie la deteriorarea ADN-ului şi la senescenţa celulară este metilarea ADN-ului, procesul care apare atunci când moleculele numite grupări metil se ataşază la anumite secţiuni ale genelor umane pentru a gestiona comportamentul acestora.
În funcţie de locul de care se prind, grupările metil pot bloca activarea genelor sau pot spori activitatea genelor acolo unde este necesar.
În general, metilarea ADN-ului scade pe măsură ce organismul îmbătrâneşte, ceea ce poate permite activarea unor gene greşite.
Cercetările au legat declinul procesului de metilare de mai multe afecţiuni legate de vârstă, inclusiv de maladia Alzheimer, boli cardiovasculare şi cancer, deşi, potrivit specialiştilor, merită menţionat faptul că nu toate modificările de metilare sunt rele.
Similar telomerilor, metilarea ADN-ului este un alt mod în care oamenii de ştiinţă pot măsura vârsta biologică pentru a estima speranţa de viaţă.
De exemplu, este posibil ca un individ care a împlinit 55 de ani, să aibă, de fapt o vârstă biologică mai mare din cauza anilor de fumat, celulele acestuia putând avea un nivel de metilare întâlnit de obicei la persoanele de 60 de ani, ceea ce ar putea să-i scurteze durata de viaţă.
În mod tradiţional, testele de metilare a ADN-ului au folosit sângele, dar graţie dezvoltării cercetării medicale s-au dezvoltat recent şi teste de salivă.
Persoanele a căror vârstă de metilare este cu cel puţin 5 ani mai mare decât vârsta lor cronologică au un risc de mortalitate cu 16% mai mare, au constatat cercetările, ceea ce înseamnă că au mai multe şanse să moară din orice cauză decât alte persoane de aceeaşi vârstă.

(Foto: Diagramă a stresului oxidativ celular. Radicalii liberi duc la stresul oxidativ, care este legat de anumite boli legate de vârstă).
Mitocondriile şi radicalii liberi sunt unele dintre cele mai mari obstacole în calea longevităţii
Nu în ultimul rând, unii dintre cei mai mari limitatori ai duratei de viaţă umane sunt mitocondriile din celulele umane. Aceste structuri microscopice generează cea mai mare parte a energiei unei celule, care este vitală pentru supravieţuire, dar creează şi produse secundare numite radicali liberi.
Radicalii liberi sunt, practic, atomi instabili care pot răni zone ale celulei umane, ducând la daune numite stres oxidativ.
În timp, stresul oxidativ se acumulează, cauzând boli legate de vârstă, cum ar fi Parkinson, Alzheimer şi cancer.
Companiile de biotehnologie, lucrează în prezent la o modalitate de a preveni aceste boli prin întinerirea celulelor şi anularea daunelor pe care le poate provoca stresul oxidativ.
Experţii speră că, prin resetarea celulelor la o stare mai sănătoasă şi mai tânără, ar putea creşte longevitatea umană.
Căutarea longevităţii nu are o singură soluţie
Pentru fiecare mecanism care contribuie la îmbătrânire, există grupuri de cercetători care lucrează pentru a înţelege şi, eventual, pentru a inversa aceste procese.
Dar este important de reţinut că acest puzzle al procesului de îmbătrânire nu are o singură soluţie.
„Toate aceste lucruri care nu merg bine cu îmbătrânirea sunt legate între ele", spune Robbins.
De exemplu, scurtarea telomerilor poate duce la deteriorarea ADN-ului, care, la rândul său, vă perturbă mitocondriile. Radicalii liberi din mitocondrii pot, la rândul lor, să deterioreze şi mai mult telomerii şi ADN-ul.
Toate aceste procese se influenţează reciproc.
Nici un mecanism de îmbătrânire nu este mai important decât celelalte. De aceea, toate cercetările anti-îmbătrânire, indiferent de nişă, sunt o parte conectată la obiectivul mai mare al umanităţii: acela de a rămâne în viaţă cât mai mult timp posibil.
(Foto articol: Containere din oţel inoxidabil pentru congelarea şi depozitarea corpurilor în azot lichid super rece la Institutul de Cercetare în Ştiinţele Vieţii Shandong Yinfeng, singurul centru de criogenie din China. Credit: Institutul de cercetare în domeniul ştiinţelor vieţii Shandong Yinfeng).





