Comisia Europeană a publicat, la finalul lunii aprilie, proiectul de revizuire a legislaţiei farmaceutice europene, una dintre mize fiind accesul mai rapid, în toate statele membre, la medicamentele inovative. Pacienţii din România aşteaptă 918 de zile, în medie, pentru a avea acces la un medicament nou autorizat, cel mai mult din Uniunea Europeană, arată ultimul studiu anual WAIT pentru anul 2022, realizat de EFPIA. Datele studiului au fost prezentate, în premieră, la evenimentul Intellectual Property and New Health Challenges, organizat de 360medical.ro, de către dr. Ioana Bianchi, director pentru Relaţii Externe în cadrul Asociaţiei Române a Producătorilor Internaţionali de Medicamente (ARPIM).
În studiul WAIT din 2021, perioada medie între autorizarea centralizată a unui medicament şi disponibilitatea efectivă pentru pacienţii români a fost de 899 de zile, ceea ce înseamnă o creştere cu 19 zile.
În UE, cel mai rapid acces la medicamente este în Germania, unde durează, în medie, 128 de zile între autorizare şi accesul efectiv al pacienţilor la medicament, potrivit studiului. Pe locurile următoare se situează Danemarca (191 zile) şi Austria (301 zile).
La polul opus, timpul cel mai mare între autorizare şi acces la medicament se înregistrează în Malta (1.351 zile), România (918 zile) şi Polonia (827 zile).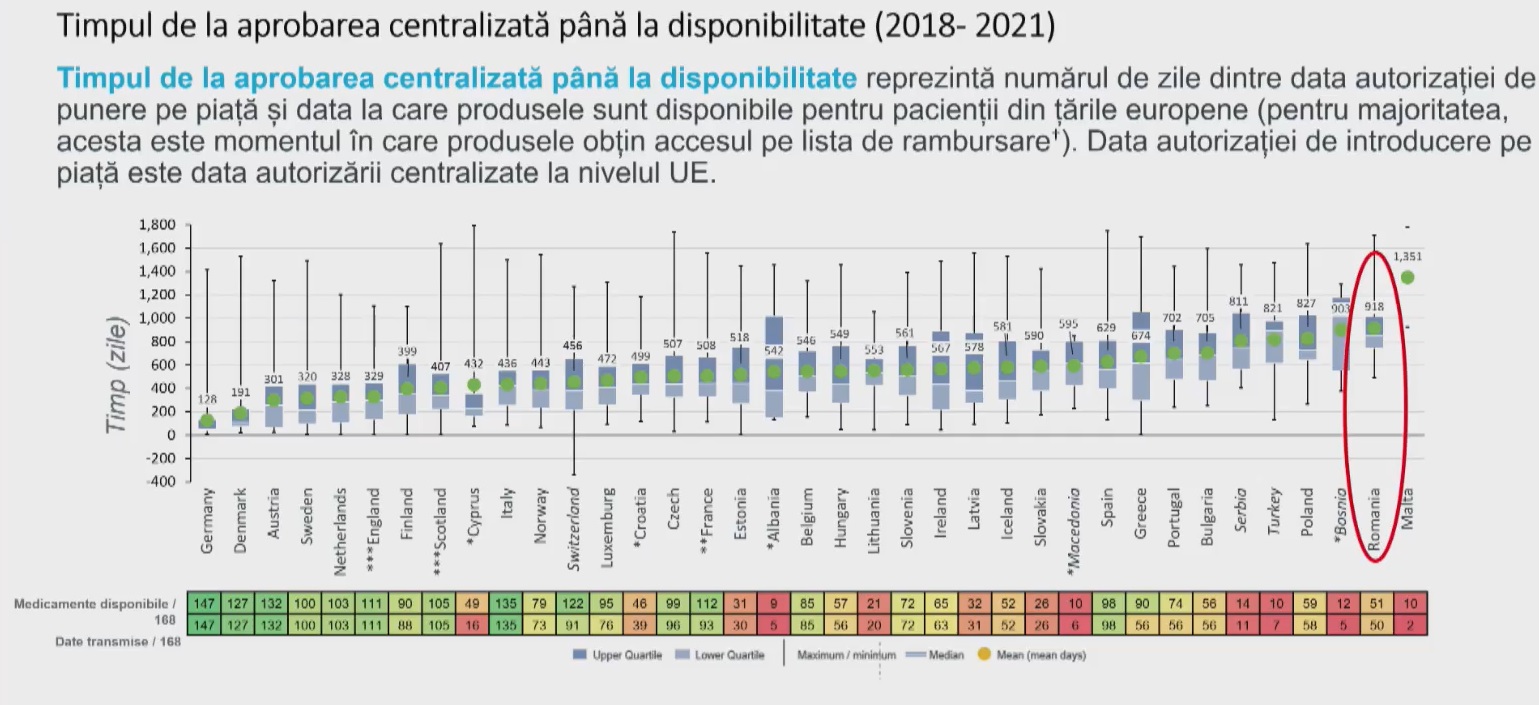
Cu toate acestea, există şi o îmbunătăţire faţă de anul anterior: unul din trei medicamente autorizate era disponibil pentru pacienţii români, faţă de unul din patru în studiul anterior.
Din datele Portalului de Acces european, implementat de EFPIA cu ajutorul IQVIA, in care companiile membre EFPIA furnizează informaţii despre depunerea dosarelor de preţuri şi rambursare în toate cele 27 de state membre ale UE, mare parte din durata de la autorizare până la accesul efectiv al pacienţilor este legată de procedurile naţionale.
"Întârzierile sunt cauzate în proporţie de 25% de companii, care depun dosarele, şi 75% de autorităţile naţionale, pentru a lua o decizie de rambursare", a afirmat dr. Ioana Bianchi.
Astfel, de la depunerea dosarului de către o companie farmaceutică există mai multe proceduri: acceptarea preţului şi includerea sa în Catalogul naţional al preţurilor medicamentelor autorizate de punere pe piaţă în România (Canamed), negocierile cu Casa Naţională pentru Asigurări de Sănătate (CNAS), aprobarea unei hotărâri de guvern pentru includerea moleculelor pe lista medicamentelor compensate şi aprobarea protocoalelor terapeutice pentru noile molecule.
"Există o lipsă de predictibilitate. În ultimii ani au fost câte două actualizări pe an a hotărârii de guvern cu molecule compensate. La fel, există o lipsă de predictibilitate privind publicarea protocoalelor terapeutice", a menţionat dr. Bianchi.
"Procedurile administrative, de la evaluare până la accesul efectiv al pacienţilor, pot dura cel puţin un an. Dacă ne întoarcem la cele peste 900 de zile, cel puţin un an este din proceduri administrative", a completat reprezentantul ARPIM.
Potrivit directorului pentru Relaţii Externe în cadrul asociaţiei, noua legislaţie farmaceutică europeană, lansată recent în dezbatere publică, deşi vizează reducerea perioadei de acces la medicamente inovative pentru pacienţi, nu ţin cont de procedurile la nivel naţional.





