Pacienţii cu scleroză laterală amiotrofică (SLA) din Statele Unite au o nouă opţiune de tratament după ce Administraţia americană de reglementare (FDA) a aprobat un tratament care încetineşte progresia bolii şi potenţial, decesul.
Administraţia SUA pentru Alimente şi Medicamente (FDA) a aprobat, joi, un medicament care încetineşte progresia sclerozei laterale amiotrofice (SLA), şi prelungeşte speranţa de viaţă.
Amylyx Pharma, deţinătoarea licenţei de punere pe piaţă, a declarat, într-un comunicat că FDA a aprobat medicamentul său care încetineşte progresia SLA şi, potenţial, decesul.
Compania farma a adăugat că profesioniştii din domeniul sănătăţii se pot apuca să scrie în curând reţete pentru medicamentul AMX0035, care urmează să fie comercializat sub numele de marcă Relyvrio.
„Ştim că persoanele care trăiesc cu SLA nu au timp să aştepte şi, din acest motiv, Amylyx este pregătită să se mişte rapid pentru comercializarea în SUA”, au declarat cei doi şefi executivi ai companiei, Josh Cohen şi Justin Klee, într-un comunicat.
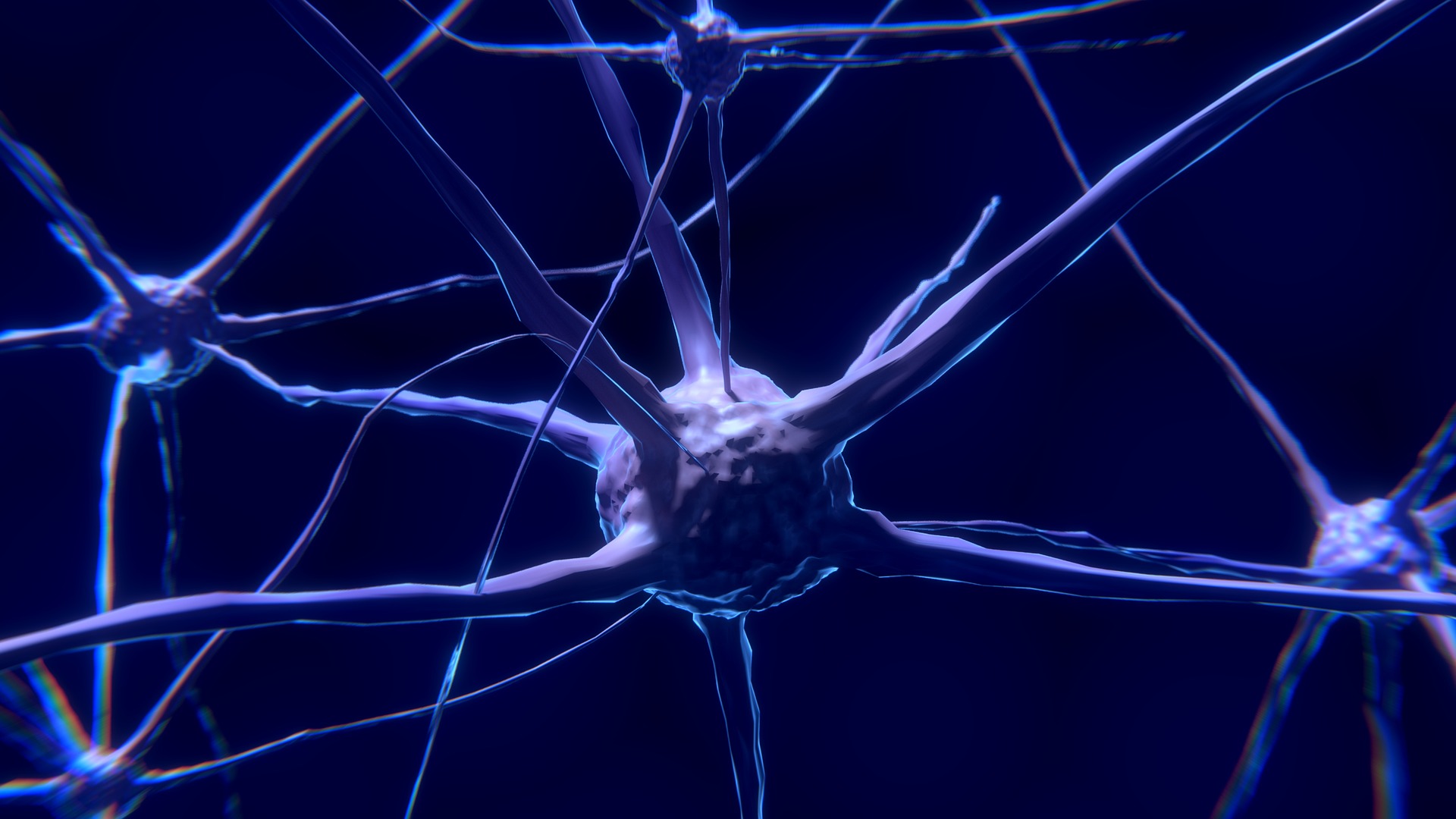
Medicamentul este o combinaţie de compuşi generici, fenilbutirat de sodiu şi taurursodiol. Compania a precizat că substanţele lucrează împreună pentru a preveni moartea prematură a celulelor nervoase din creier şi măduva spinării.
SLA, cunoscută şi sub numele de boala Lou Gehrig, afectează celulele nervoase din creier şi măduva spinării care coordonează mişcarea muşchilor din corp, ducând la paralizie progresivă şi, în cele din urmă, la deces. Boala afectează mai mult de 30.000 de pacienţi în Statele Unite, potrivit grupului de susţinere a pacienţilor The ALS Association.
Aprobarea medicamentului ar reprezenta un progres semnificativ pentru comunitatea pacienţilor cu SLA, care are puţine opţiuni de tratament, a declarat anterior Justin Klee, CEO adjunct şi co-fondator al companiei.
Medicamentul AMX0035, care a primit aprobare condiţionată şi în Canada, în iunie, este primul tratament finanţat de donaţiile provenite din provocarea Găleţii cu gheaţă - ALS Ice Bucket Challenge, luat în considerare pentru aprobare de către FDA, provocare care a devenit virală pe reţelele de socializare.
Cererea de aprobare s-a bazat pe o analiză recentă a datelor din studiile clinice care a arătat că medicamentul încetineşte progresia bolii şi prelungeşte speranţa de viaţă cu aproape 10 luni.
Este al treilea medicament pentru SLA care a fost aprobat de FDA în Statele Unite, după Radicava, al companiei japoneze Mitsubishi Tanabe, şi medicamentul generic riluzol.
AMX0035 se află, din februarie anul acesta, şi sub evaluarea Agenţiei Europene a Medicamentului (EMA), şi aşteaptă decizia Agenţiei în privinţa utilizării în Uniunea Europeană.
Tot joi, compania Biohaven a declarat că medicamentul său experimental pentru tratarea sclerozei laterale amiotrofice a eşuat într-un studiu clinic.
Compania a precizat că medicamentul său pentru SLA nu a obţinut o îmbunătăţire semnificativă statistic a performanţei pacienţilor în activităţile zilnice, în comparaţie cu un placebo, într-un studiu clinic de fază mijlocie.
SLA este o boală neuromusculară progresivă care pune viaţa în pericol, vârsta medie de supravieţuire fiind de 3-5 ani de la apariţia primelor simptome, dar unii pacienţi, precum Stephen Hawking, au trăit mult mai mult.
Aprobarea FDA pentru AMX0035 vine după ce un grup de consilieri externi în domeniul sănătăţii şi-a schimbat decizia şi a recomandat pozitiv medicamentul experimental mult disputat, pe 8 septembrie, după un vot de 7-2 în favoarearea rezultatelor studiului de susţinere, care a fost respins iniţial de acelaşi grup, la începutul acestui an.
Schimbarea deciziei experţilor a survenit după o reanalizare a datelor studiului şi după ce şeful Biroului de Neuroştiinţe al FDA, Billy Dunn, care a analizat medicamentul, i-a îndemnat pe consilieri să ia în considerare „flexibilitatea reglementărilor” în luarea deciziei, spunând că medicamentul ar putea fi scos de pe piaţă ulterior, dacă eşuează într-un studiu mai amplu, aflat în curs de desfăşurare.
Decizia FDA vine, de asemenea, după luni de lobby din partea pacienţilor care au îndemnat autorităţile de reglementare să aprobe medicamentul, întrucât s-a dovedit relativ sigur şi a demonstrat că are potenţialul să prelungească supravieţuirea.