Agenţia Europeană a Medicamentului (EMA) a realizat un proiect care conţine principiile trecerii la informaţiile despre produsele farmaceutice în format electronic (ePI), cu conţinut standardizat şi disponibil în toate limbile oficiale din statele membre ale Uniunii Europene pe diferite platforme digitale, inclusiv prin intermediul unor aplicaţii pentru smartphone sau prin scanarea codului de bare al unei cutii de medicamente, spre exemplu.
În prezent, informaţiile standard despre medicamente sunt disponibile în UE sub forma prospectului pentru pacienţi din interiorul cutiilor şi a rezumatului caracteristicilor produsului (RCP) pentru profesioniştii din sănătate.
În format electronic, aceste informaţii sunt disponibile în principal sub forma unor fişiere PDF.
Însă în cadrul strategiei eHealth, EMA intenţionează să facă disponibile informaţiile despre medicamente în format electronic, ceea ce ar oferi acces la aceste informaţii validate unui public mai larg.
EMA a realizat un document care conţine principiile care vor ghida implementarea ePI, lansat joi în dezbatere publică pentru 6 luni.
“ePI reprezintă informaţie autorizată, reglementată despre medicamente într-un format organizat, creat pe baza unui format electronic standard, comun în întreaga UE. ePI este adaptat pentru dispozitive electronice şi permite diseminarea prin internet, platforme electronice şi în format printabil”, se menţionează în proiect.
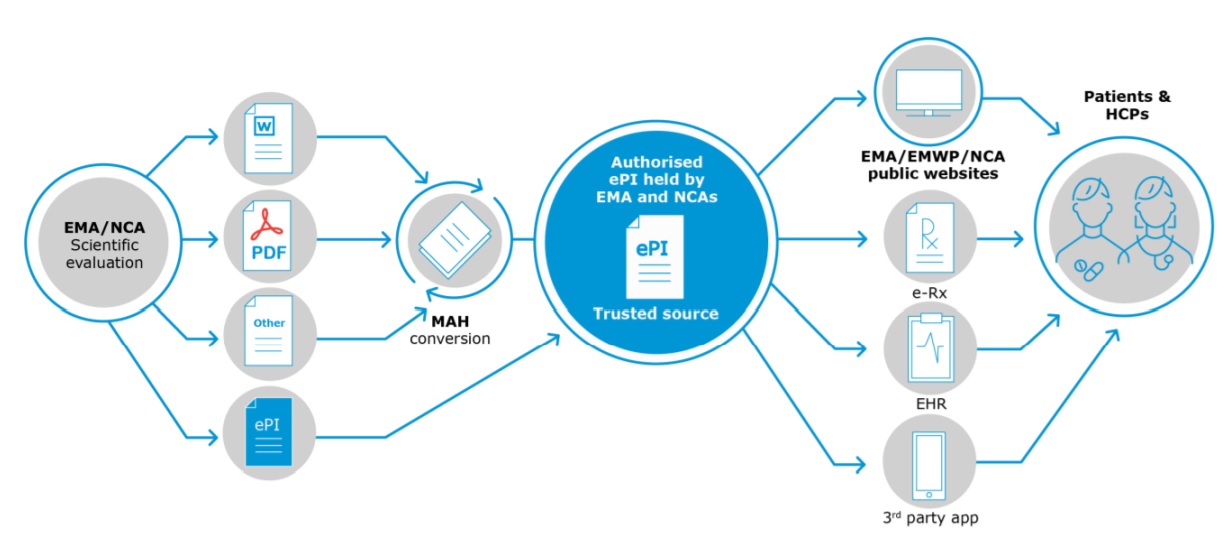
Primul pas în trecerea către ePI este realizarea unui standard al informaţiilor electronice, care să ţină seama de tehnologia actuală şi să permită actualizări pe viitor, pe măsura evoluţiei tehnologice.
Ulterior, toate informaţiile actuale despre medicamente, disponibile în formate tradiţionale, urmează să fie transformate în formatul ePI, sub supravegherea unei autorităţi de reglementare (EMA sau autorităţi re reglementare naţionale, precum ANMDM, în cazul României), iar apoi conţinutul ePI va ajunge la utilizatori (pacienţi şi profesionişti în domeniul sănătăţii) prin mai multe canale: site EMA, fişiere electronice standardizate, aplicaţii dezvoltate de terţi (precum companii IT private) pentru dispozitive electronice (smarthphone, tabletă etc) - precum în graficul de mai sus.
“ePI reprezintă o prioritate în materie de sănătate publică deoarece va extinde diseminarea de informaţii despre toate medicamentele nealterate, actualizate şi aprobate de o autoritate de reglementare în Uniunea Europeană”, arată proiectul.
Unul dintre avantajele introducerii ePI este faptul că, prin intermediul noului format, informaţiile despre produsele farmaceutice pot fi actualizate rapid şi pot ajunge la pacienţi şi la medici mult mai repede decât în formatul tradiţional.
EMA subliniază că ePI trebuie să poată fi accesibil în toate limbile din UE, precum şi în islandeză şi norvegiană, şi să permită folosirea unor tehnologii şi aplicaţii diverse, inclusiv prin tehnologia de scanare mobilă (precum scanarea codurilor de bare de pe cutiile de medicamente).
Totuşi, EMA avertizează că ePI nu va fi implementată în acelaşi timp în toate statele din UE, deoarece unele ţări vor înregistra dificultăţi mai mari.
“Dimensiunea şi complexitatea obiectivului de realizare a ePI pentru medicamentele din UE sunt atât de mari, încât este nerealist să se aibă în vedere implementarea simultană în întreaga UE”, arată proiectul.
În plus, EMA arată că ePI s-ar putea dovedi o povară pentru unele state membre, dar şi pentru unele companii mici sau mijlocii din UE sau pentru producătorii de medicamente generice.





