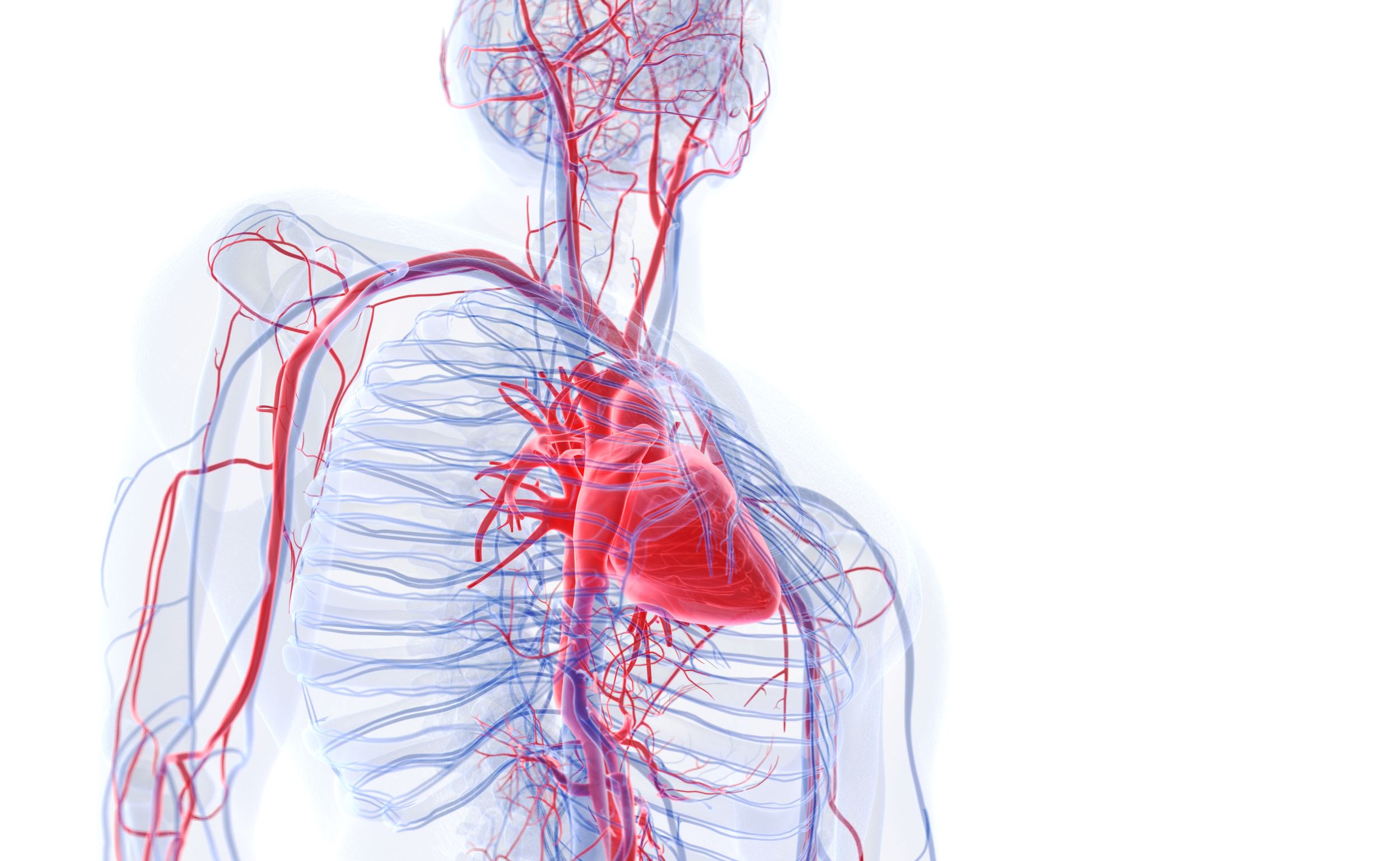
Hipertensiunea arterială pulmonară (HTAP/HAP) este o afecţiune rară, progresivă care poate pune viaţa în pericol, şi se caracterizează prin îngustarea vaselor mici de sânge din plămâni, ceea ce provoacă o presiune semnificativă asupra inimii.
Grupul farmaceutic german Merck a anunţat joi că Administraţia americană pentru alimente şi medicamente (FDA) a acceptat revizuirea prin procedură prioritară în cazul terapiei sale experimentale pentru tratarea HTAP la adulţi.
Aproximativ 40.000 de persoane din Statele Unite trăiesc cu HAP. Boala progresează rapid pentru mulţi pacienţi.
Afecţiunea are ca rezultat o presiune semnificativă asupra inimii, ceea ce duce la limitarea activităţii fizice, insuficienţă cardiacă şi reducerea speranţei de viaţă.
Rata mortalităţii la cinci ani pentru pacienţii cu HAP este de aproximativ 43%.
Aplicaţia pentru autorizarea tratamentului se bazează pe datele unui studiu de fază 3 (STELLAR), în cadrul căruia medicamentul administrat în plus faţă de terapia de bază, a demonstrat o îmbunătăţire semnificativă, din punct de vedere statistic şi clinic, a distanţei de mers în 6 minute (6MWD) şi a opt din nouă evenimente evaluate.
Rezultatele au fost prezentate la cea de-a 72-a Sesiune Ştiinţifică Anuală a Colegiului American de Cardiologie, împreună cu Congresul Mondial de Cardiologie al Federaţiei Mondiale a Inimii (ACC.23/WCC), şi publicat simultan în The New England Journal of Medicine.
FDA a stabilit data de 26 martie 2024 ca termen de acţiune pentru examinarea terapiei, sotatercept, un inhibitor biologic a semnalizării activinei umane, a precizat Merck.
Dacă va fi autorizat, medicamentul ar fi primul din clasa sa, aducând o abordare nouă pentru o boală rară şi progresivă a arterelor pulmonare.