Bolile neurodegenerative devastatoare precum Huntington, Alzheimer şi Parkinson sunt asociate cu depozite de proteine în creier, cunoscute sub numele de amiloid. În ciuda investiţiilor ample în cercetare, în ceea ce priveşte cauza şi toxicitatea amiloidului, descifrarea primului pas în debutul acestor boli, precum şi dezvoltarea unor terapii eficiente, a rămas evazivă.
Pentru prima dată, oamenii de ştiinţă de la Institutul american pentru cercetări medicale Stowers au descoperit structura primului pas, nucleul, în formarea amiloidului pentru boala Huntington.
Studiul publicat marţi, în eLife, propune o metodă nouă şi radicală pentru tratarea bolii Huntington, şi, potenţial, a altor zeci de boli asociate cu amiloidul - împiedicarea apariţiei pasului iniţial al bolii, care ar putea limita rata de apariţie a acestora.
„Este pentru prima dată când se determină experimental structura unui nucleu amiloid, în ciuda faptului că majoritatea bolilor neurodegenerative majore sunt asociate cu amiloidul", a declarat profesorul Randal Halfmann, care a condus cercetarea.
„Unul dintre marile mistere ale bolilor Huntington, Alzheimer şi sclerozei laterale amiotrofice (SLA) este de ce boala coincide cu amiloidul, însă acesta nu este, în sine, principalul vinovat", spune profesorul.
În noul studiu, cercetătorii au identificat în mod unic structura nucleului amiloid pentru huntingtină, proteina responsabilă de boala Huntington, descoperind că nucleul se formează în cadrul unei singure molecule de proteină.
Proteinele sunt muncitorii fabricilor celulare construite din secvenţe unice de 20 de aminoacizi, elementele fundamentale (blocurile) de construcţie.
Unele proteine prezintă repetări ale unuia dintre aceşti aminoacizi - glutamina (prescurtat Q).
Boala Huntington şi alte opt boli, denumite colectiv „boli PolyQ", apar atunci când anumite proteine au o secvenţă repetitivă prea lungă. Cumva, acest lucru face ca proteinele să se plieze într-o structură specifică care declanşează o reacţie în lanţ care ucide celula.
„Timp de trei decenii, am ştiut că boala Huntington şi bolile fatale conexe apar atunci când proteinele conţin mai mult de aproximativ 36 de secvenţe Q la rând, ceea ce le determină să formeze lanţuri de proteine în creier, dar nu ştiam de ce", a declarat prof. Halfmann.
„Acum ne-am dat seama cum arată prima verigă a acestui lanţ şi, astfel, am descoperit o nouă modalitate de a-l opri", a precizat el.

(Ilustraţie grafică a nucleului polyQ. Glutaminele (Q) intercalate între două straturi de beta-amiloid cu două catene. Credit: Institutul Stowers pentru cercetare medicală).
O schimbare de paradigmă şi o potenţială metodă terapeutică
Aceste noi descoperiri reprezintă o potenţială schimbare de paradigmă pentru modul în care este privit amiloidul.
Rezultatele acestei cercetări sugerează că primele etape ale formării amiloidului, imediat după formarea nucleului, sunt cele care provoacă moartea celulelor neuronale.
Pe lângă faptul că au descoperit structura cheie care începe formarea amiloidului polyQ, cercetătorii au descoperit că aceasta se formează doar în molecule izolate de proteină.
Agregarea proteinelor în celule a oprit complet formarea amiloidelor. Aceasta este o nouă cale terapeutică pe care echipa plănuieşte să o exploreze în continuare pe şoareci şi pe organoizi cerebrali.
O nouă tehnică
O tehnică dezvoltată recent de laboratorul profesorului Halfmann, numită DAmFRET (Distributed Amphifluoric Förster Resonance Energy Transfer), arată modul în care o proteină se autoasamblează în celule individuale.
Această metodă s-a dovedit a fi crucială pentru a observa limitarea ratei de formare a amiloidului.
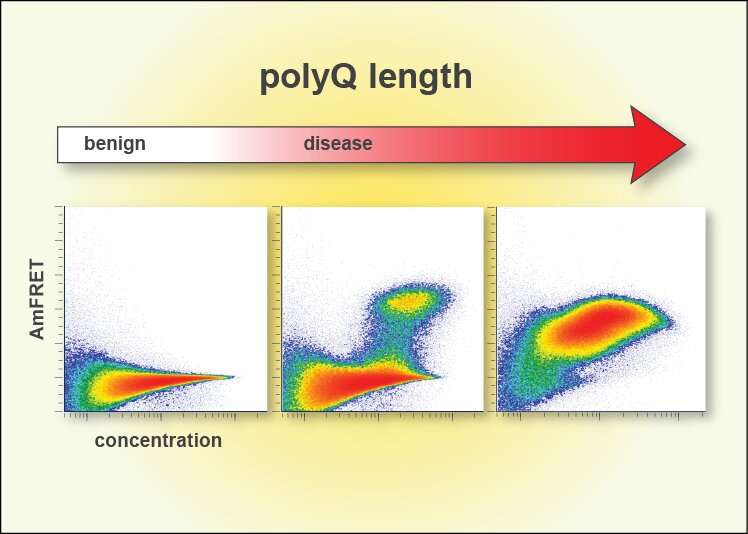
(Diagrame DAmFret care ilustrează gradul de autoagregare a glutaminei (Q) pe măsură ce creşte numărul de secvenţe Q (stânga: secvenţe Q mai mici de 36; centru: secvenţe Q în jur de 50; dreapta: secvenţe Q peste 100). Credit: Stowers Institute for Medical Research).
„O inovaţie cheie a fost aceea de a minimiza volumul reacţiei într-o asemenea măsură încât să putem asista la stocasticitatea sa, sau la caracterul aleatoriu, şi apoi să modificăm secvenţa pentru a ne da seama ce guvernează acest lucru", a declarat prof. Halfmann.
Proiectarea şi testarea unor modele specifice de secvenţe Q a permis echipei să deducă structura minimă care ar putea forma amiloidul - un mănunchi de patru şiruri, fiecare cu trei secvenţe Q în locaţii specifice.
Acest cristal minuscul din interiorul unei singure molecule de proteină este primul pas într-o reacţie în lanţ care duce la boală.
„Lucrările anterioare în eprubete susţin un nucleu monomeric, dar acest model a fost controversat", a declarat prof. Halfmann.
„Acum avem dovezi puternice că o secvenţă de 36 Q este numărul critic pentru ca formarea nucleului să aibă loc în moleculele unice de proteină şi, mai mult, că asta este ceea ce se întâmplă în interiorul celulelor vii", a precizat el.
În esenţă, acest studiu oferă un model molecular pentru a investiga structura oricărui nucleu amiloid.
În plus, corelaţia dintre îmbătrânire şi amiloizi sugerează că această metodă ar putea, în cele din urmă, să descopere mecanismele moleculare care cauzează îmbătrânirea.
Abordarea preventivă de a elimina sau cel puţin de a întârzia procesul de formare a nucleului oferă speranţă pentru persoanele cu proteine PolyQ patologice.
„Paradigma emergentă este că totul rezultă dintr-un singur eveniment, o schimbare spontană a formei proteinelor", a spune prof. Halfmann.
„Acest eveniment declanşează reacţia în lanţ pentru amiloidele care ucid celulele şi poate oferi o perspectivă cheie asupra modului în care amiloidele provoacă boli", a explicat el.





