Comisia pentru medicamente pentru uz uman a Agenţiei Europene a Medicamentului (EMA) a recomandat aprobarea unui nou medicament dezvoltat de compania farmaceutică irlandeză Shire pentru pacienţii cu vârsta de cel puţin 12 ani cu angioedem ereditar, relatează Reuters.
Administraţia SUA pentru Alimente şi Medicamente (FDA) a aprobat deja anticorpul monoclonal pentru tratamentul pacienţilor angioedem ereditar de tip I şi II.
Medicamentul Takhzyro (substanţa lanadelumab) a intrat în portofoliul Shire după achiziţionarea companiei americane Dyax pentru 5,9 miliarde de dolari, în 2016.
Experţii estimează că tratamentul ar putea genera vânzări maxime anuale de circa 2 miliarde dolari.
În prezent există doar câteva tratamente disponibile pentru angioedem ereditar, boală care afectează aproximativ una din 50.000 de persoane.
Deşi aprobările finale revin Comisiei Europene, aceasta urmează de obicei recomandarea comisiei EMA şi anunţă decizia la circa două luni după emiterea recomandării.
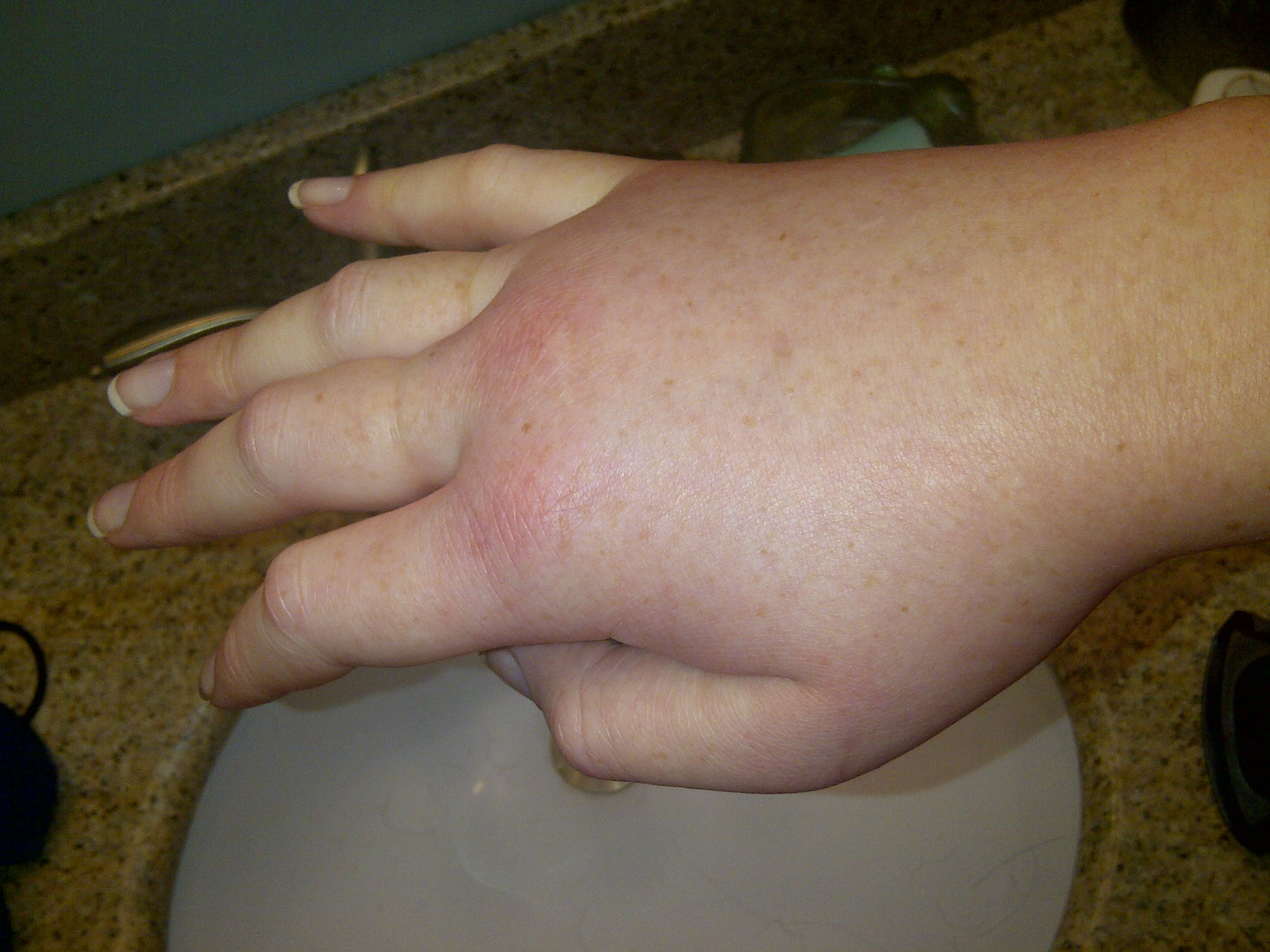
Angioedemul ereditar este o afecţiune genetică, rară, care se manifestă prin umflături ale ţesutului subcutanat periferic la nivelul membrelor şi feţei sau a mucoaselor la nivelul abdomenului şi căilor respiratorii. Boala debutează în copilărie, iar pacienţii suferinzi de angioedem ereditar riscă să moară prin asfixie.
În România erau înregistraţi oficial 92 de bolnavi cu angioedem ereditar în 2016, însă numărul lor real este estimat la cel puţin 400.
Recent, EMA a aprobat comercializarea în Uniunea Europeană a medicamentului Veyvondi, dezvoltat de grupul farmaceutic irlandez Shire pentru pacienţii cu boala von Willebrand, cea mai frecventă afecţiune a sistemului de coagulare a sângelui.