După aproape 40 de ani de cercetare, oamenii de ştiinţă ar putea fi mai aproape ca niciodată de a elimina definitiv gripa. Cercetând lumea complexă a virusului gripei A, cercetătorii francezi au aflat acum modul în care acest invadator microscopic îşi împachetează şi îşi protejează materialul genetic.
Pentru a combate virusul care provoacă gripa, una dintre pistele explorate de oamenii de ştiinţă este dezvoltarea de medicamente capabile să destabilizeze genomul acestuia, alcătuit din opt molecule de ARN. Provocarea este însă descurajantă: fiecare moleculă de ARN este strâns legată de un ansamblu de proteine care creează o spirală dublă, formând un strat protector dificil de manipulat.
Un studiu, publicat zilele acestea în revista Nucleic Acids Research, oferă, pentru prima dată, o perspectivă uimitoare asupra modului în care virusul îşi construieşte structura internă, ceea ce ar putea deschide noi căi de combatere a infecţiilor virale şi de fabricare a unor medicamente mai bune pentru sezonul gripal.
Virusurile gripale sunt cunoscute pentru faptul că provoacă epidemii sezoniere şi, ocazional, pandemii, existând pericolul actual ca tulpinile de gripă aviară să poată trece de la animale la oameni. În centrul capacităţii virusului de a se răspândi şi de a supravieţui se află materialul său genetic, învelit cu grijă într-un strat proteic vizibil doar cu ajutorul microscopului de forţă atomică.
Folosind tehnici de imagistică de ultimă oră, oamenii de ştiinţă au creat cea mai detaliată hartă de până acum a modului în care virusul îşi asamblează materialul genetic. Cercetarea s-a axat pe nucleoproteină, o proteină esenţială care acţionează ca un înveliş protector pentru ARN-ul virusului - instrucţiunile sale genetice.
Echipa a utilizat o abordare sofisticată pentru a descompune şi reconstrui structura proteică a virusului într-un cadru de laborator. Prin îndepărtarea unor porţiuni mici din structura proteinei, ei au reuşit să creeze versiuni mai stabile şi mai puţin mutante ale materialului genetic de bază al virusului. Acest lucru le-a permis să capteze imagini incredibil de clare care dezvăluie modul în care materialul genetic este dispus în structura proteinei.
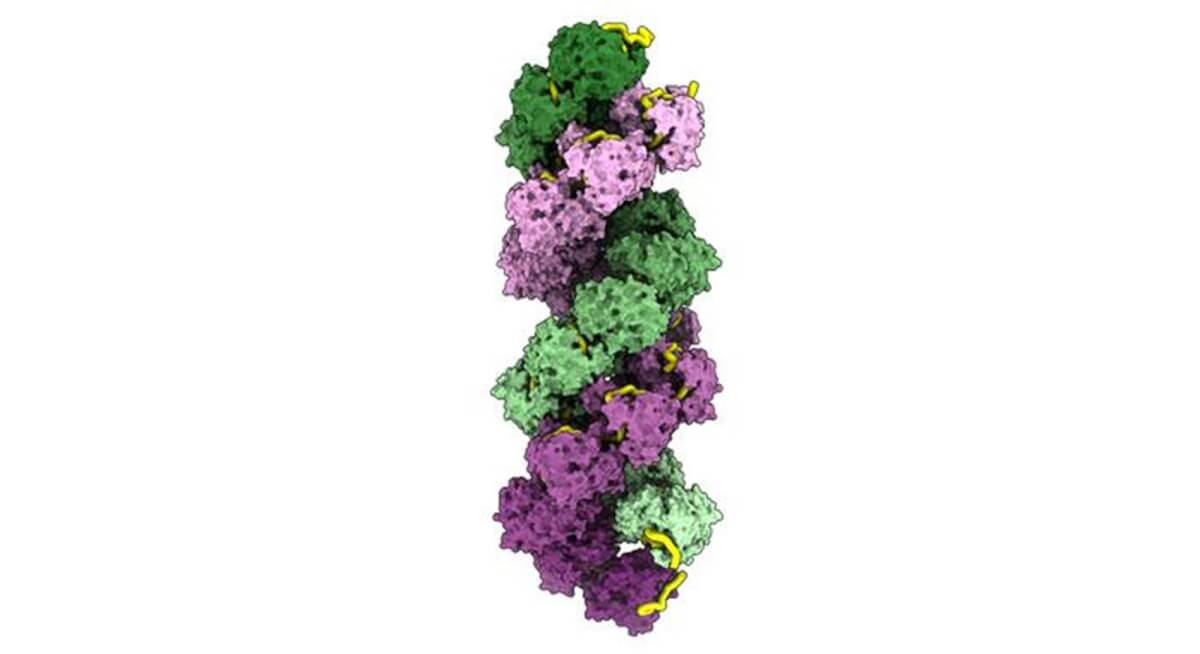 Reconstrucţie 3D a aranjamentului unei molecule de ARN a virusului gripal (galben) în învelişul său proteic dublu-helix (violet şi verde). Vizualizarea cu microscopul atomică a acestor interacţiuni protectoare intime deschide calea către dezvoltarea de molecule care, prin interferenţa dintre ARN şi învelişul său protector, ar putea constitui un mijloc eficient de prevenire a replicării virusului. Credit: Chenavier-Crépin, 14 decembrie 2024
Reconstrucţie 3D a aranjamentului unei molecule de ARN a virusului gripal (galben) în învelişul său proteic dublu-helix (violet şi verde). Vizualizarea cu microscopul atomică a acestor interacţiuni protectoare intime deschide calea către dezvoltarea de molecule care, prin interferenţa dintre ARN şi învelişul său protector, ar putea constitui un mijloc eficient de prevenire a replicării virusului. Credit: Chenavier-Crépin, 14 decembrie 2024
Una dintre cele mai surprinzătoare descoperiri a fost flexibilitatea ambalajului genetic al virusului. Cercetătorii au descoperit că proteina poate găzdui între 20 şi 24 de blocuri genetice, cu o parte a proteinei mai adaptabilă decât cealaltă. Această flexibilitate ar putea explica modul în care virusul se poate schimba şi adapta rapid - un motiv esenţial pentru care gripa este atât de dificil de combătut în fiecare an.
Studiul a dezvăluit, de asemenea, interacţiuni complexe între proteină şi materialul genetic. ARN-ul (materialul genetic) nu stă doar pasiv în interiorul proteinei, ci contribuie activ la modelarea structurii virusului. Acesta acţionează atât ca un ciment, cât şi ca un distanţier, contribuind la flexibilitatea generală a particulei virale.
În mod important, cercetătorii au observat că primii 14 aminoacizi ai proteinei joacă un rol crucial în două funcţii-cheie: asigură flexibilitatea virusului şi îl ajută să se deplaseze în interiorul celulelor gazdă. Această descoperire ar putea fi o ţintă potenţială pentru viitoarele strategii antivirale.
„Această descoperire deschide calea pentru proiectarea de noi molecule de medicament capabile să se lege de învelişul proteic, să slăbească ARN-ul viral şi să inhibe replicarea virusului gripal, ale cărui epidemii afectează între 2 şi 6 milioane de persoane în Franţa în fiecare iarnă şi provoacă aproximativ 10.000 de decese la persoanele sensibile”, scrie într-un comunicat echipa de la CNRS (Centrul Naţional Francez de Cercetări Ştiinţifice) şi l'Université Grenoble Alpes.
Deşi studiul a fost efectuat într-un cadru de laborator controlat, acesta reprezintă un pas esenţial în desluşirea mecanismelor complexe ale uneia dintre cele mai adaptabile şi persistente ameninţări virale din lume.
Întrucât gripa continuă să reprezinte o provocare pentru sănătatea mondială, astfel de informaţii la nivel molecular oferă speranţa unor intervenţii mai bine direcţionate şi mai eficiente.
Pentru publicul larg, această cercetare subliniază complexitatea incredibilă a virusurilor şi lupta continuă dintre inovaţia ştiinţifică umană şi agenţii patogeni invizibili (microscopici), reamintindu-ne cât de multe am învăţat - şi cât de multe mai sunt de descoperit - despre organismele minuscule care pot avea un impact atât de mare asupra sănătăţii umane.
Rezumatul cercetării
În cadrul cercetării prezentate, echipa a dezvoltat o structură recombinantă de tip nucleocapsidă elicoidală pentru a explora interacţiunile din cadrul ribonucleoproteinei (RNP) virusului gripei A. Acest lucru a fost realizat prin utilizarea unor forme trunchiate ale nucleoproteinei virale (NP) combinate cu fragmente sintetice de ARN. Tehnica experimentală de bază a implicat microscopia crioelectronică (crio-EM) pentru a vizualiza structurile la o rezoluţie de până la 3,0 Å. Diferite construcţii ale NP au fost create, exprimate şi purificate, permiţând cercetătorilor să observe modul în care variaţiile din NP au contribuit la formarea şi stabilitatea structurilor de tip nucleocapsidă.
Rezultate cheie
Studiul a reuşit să cartografieze detaliile complexe ale arhitecturii RNP a virusului gripal A prin utilizarea crio-EM, dezvăluind faptul că deleţia parţială a cozii N-terminale a NP stabilizează ansamblul de tip nucleocapsidă. Această manipulare a facilitat o vizualizare detaliată a interacţiunilor NP-NP şi NP-ARN, evidenţiind flexibilitatea proteinei şi implicaţiile acesteia pentru încapsidarea ARN. În special, cercetătorii au constatat că variaţia lungimii ARN a afectat formarea elicelor monocatenare şi bicatenare, anumite lungimi favorizând interacţiuni şi formaţiuni de asamblare mai stabile.
Limitările studiului
O limitare a studiului este utilizarea unor versiuni trunchiate ale NP şi ARN sintetic, care ar putea să nu reproducă pe deplin interacţiunile şi conformaţiile naturale prezente în RNP viral al gripei A. În plus, deşi crio-EM oferă informaţii structurale semnificative, limitările rezoluţiei înseamnă că unele interacţiuni la nivel atomic ar putea să nu fie pe deplin identificate. Prin urmare, extrapolarea acestor rezultate pentru a înţelege comportamentul complet al virusului în sistemele biologice necesită o analiză atentă şi o validare suplimentară.
Concluziile cercetării
Constatările subliniază faptul că flexibilitatea nucleoproteinei virusului gripal A este esenţială pentru capacitatea acestuia de a încapsida ARN în mod eficient, un factor care ar putea influenţa replicarea virală şi adaptarea gazdei. Capacitatea de a modifica NP pentru a stabiliza diferite forme elicoidale oferă un instrument valoros pentru studii suplimentare privind asamblarea şi patogenitatea virusului. Înţelegerea acestor mecanisme ar putea conduce la noi strategii antivirale care vizează componentele structurale ale virusului.
Finanţare
Cercetarea a fost susţinută de Şcoala Postuniversitară de Chimie Biologie Sănătate a Universităţii Grenoble Alpes şi de Agenţia naţională franceză pentru cercetare.