Limfomul difuz cu celule B mari (DLBCL) este cea mai frecventă formă de limfom, afectând anual aproximativ 30.000 de pacienţi numai în Statele Unite. Un mecanism surprinzător care face ca unele dintre aceste cancere să fie rezistente la tratament a fost descoperit de cercetătorii americani.
În cadrul unui proiect de cercetare fundamentală şi studii clinice, o echipă de cercetători de la Weill Cornell Medicine şi NewYork-Presbyterian a demonstrat că o combinaţie de chimioterapii aprobate, dintre care una vizează mecanismul de facilitare a reparării ADN-ului, ar putea ajuta la tratarea acestor cazuri persistente.
Echipa a descoperit că un mecanism care implică deplasarea ARN-ului mesager (ARNm) din nucleu în citoplasmă facilitează repararea ADN-ului în celulele canceroase. Aceste celule canceroase pot astfel să contracareze tratamentele menite să le afecteze ADN-ul.
Deşi studiul, publicat recent în revista Cancer Research, s-a concentrat pe limfomul difuz cu celule B mari (DLBCL), constatările se aplică probabil şi altor tipuri de cancer, spun cercetătorii.
DLBCL este cea mai frecventă formă de limfom, afectând anual aproximativ 30.000 de pacienţi numai în Statele Unite.
Terapiile de primă linie vindecă aproximativ două treimi dintre pacienţi, „dar pentru persoanele care nu sunt vindecate sau care recidivează, acestea au avut, din punct de vedere tradiţional, rezultate slabe cu abordările terapeutice standard bazate pe chimioterapie", spune coautorul principal, dr. Sarah Rutherford, profesor asistent de medicină la Weill Cornell Medicine şi oncolog specialist în hematologie la NewYork-Presbyterian şi Centrul medical Cornell.
Cercetările anterioare au demonstrat că celulele DLBCL rezistente la tratament exprimă adesea niveluri ridicate ale unei proteine numite XPO1.
În 2019, Administraţia pentru Alimente şi Medicamente (FDA), din Statele Unite, a aprobat un nou medicament, selinexor, care a fost conceput pentru a viza XPO1 şi pentru a-i inhiba activitatea.
Medicamentul, autorizat şi în Uniunea Europeană pentru mielomul multiplu, împiedică creşterea celulelor de limfom care exprimă niveluri ridicate ale proteinei, fiind utilizat pentru a trata aceste cazuri refractare.
Tratamentul ajută, dar nu pe toţi pacienţii cu boală rezistentă la tratament.
„Medicamentul este eficient, doar că nu atât de eficient pe cât ne-am dori să fie", a declarat dr. Rutherford. Asta a determinat-o să caute modalităţi de a îmbunătăţi eficacitatea tratamentului.
Echipa şi-a propus să afle mai multe despre modul exact în care funcţionează selinexor. Ţinta sa, XPO1, transportă sute de proteine şi anumite ARN-uri în afara nucleului celular, în primul rând pentru a separa fondul de proteine care nu ar trebui să fie prezente în nucleu, cum ar fi proteinele ribozomiale.
Cu toate acestea, cercetătorii au descoperit că unele dintre aceste proteine exportate de XPO1 sunt, de asemenea, legate de molecule de ARNm; astfel, aceste ARNm sunt exportate din nucleul celular în citoplasmă, unde pot fi traduse în proteine.
Acest nou mecanism indică faptul că, prin urmare, cantitatea şi activitatea XPO1 într-o celulă pot afecta nivelurile de expresie a numeroase gene.
„Am descoperit că nu reglează doar câteva proteine, ci coordonează aceste programe mari, permiţând celulelor să îşi ajusteze rapid proteomul şi să supravieţuiască diferitelor tipuri de stres cu care celulele canceroase se confruntă tot timpul", a declarat autorul principal, dr. Leandro Cerchietti, profesor asociat de hematologie şi oncologie şi membru la Centrul de cancer Meyer de la Cornell Medicine.
Luând unele celule DLBCL rezistente la tratament de la pacienţi şi grefându-le în modele preclinice, cercetătorii au descoperit că nivelurile mai ridicate de XPO1 cresc în cele din urmă expresia genelor care protejează celulele împotriva morţii cauzate de deteriorarea ADN-ului.
Inhibarea XPO1 în aceste modele cu selinexor a crescut sensibilitatea limfoamelor la chimioterapiile care dăunează ADN-ului şi la tratamentele bazate pe imunitate.
„Am fost entuziasmaţi şi ne-am gândit că selinexor ar putea avea sinergii cu alte chimioterapii", a declarat dr. Rutherford.
Pentru a testa acest lucru la pacienţi, ea a iniţiat un studiu clinic de fază 1, cu scopul de a determina dacă o astfel de combinaţie ar fi sigură şi, dacă da, la ce doze.
Studiul, la care au participat în principal pacienţi cu DLBCL rezistent la tratament, a arătat că regimul combinat nu numai că este sigur, dar pare să funcţioneze.
Deşi setul de date este prea mic pentru a trage concluzii definitive, mai mulţi pacienţi au avut rezultate mai bune decât se aşteptau.
Dr. Rutherford îşi propune să continue să testeze şi să perfecţioneze noile regimuri în cadrul unor studii ulterioare.
În această boală, avem acum mult mai multe terapii decât aveam când am început studiul, a spus ea.
Deoarece fiecare celulă din organism exprimă XPO1, noile rezultate sunt susceptibile de a avea aplicaţii mai largi.
Potrivit autorilor, există şi alte tumori în care XPO1 este supraexprimată.
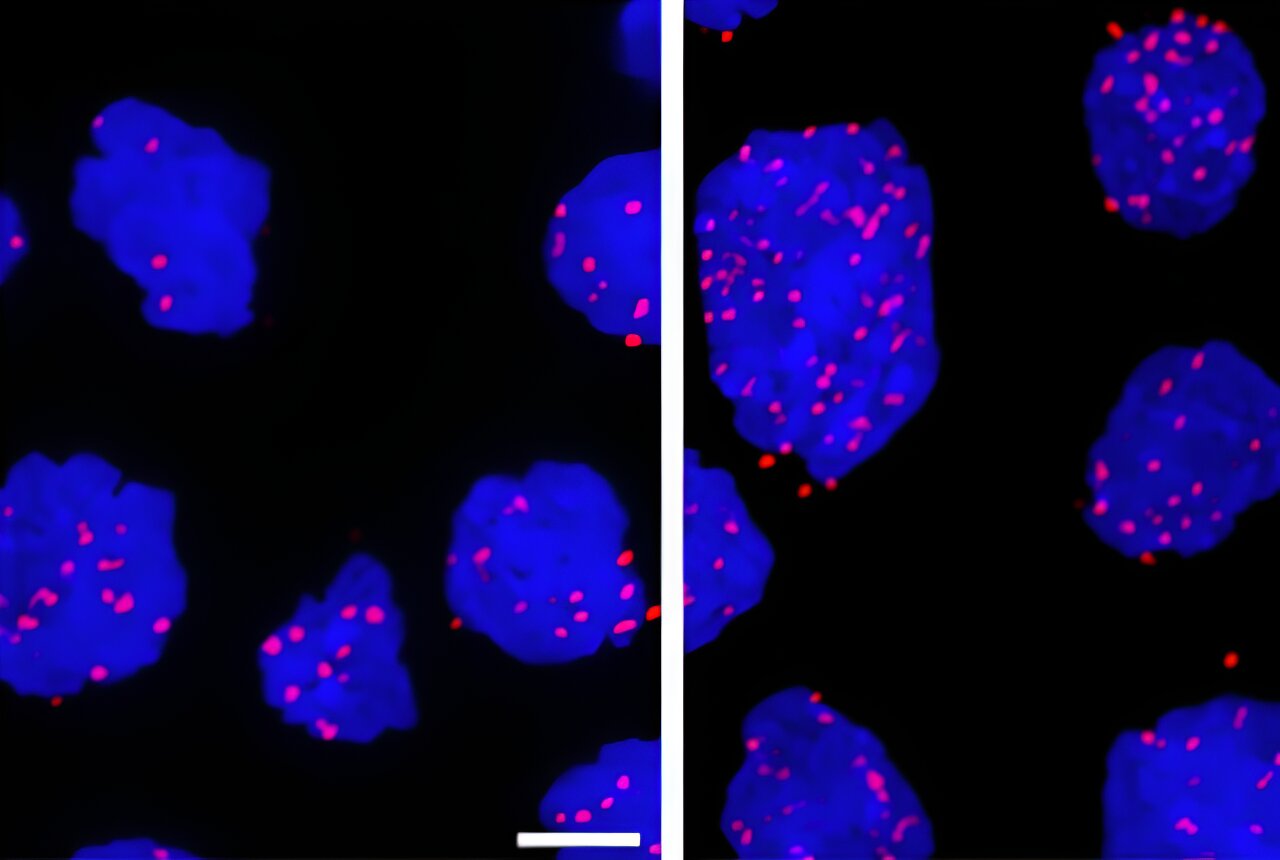
Foto: Celule de limfom cu celule B mari difuze netratate (stânga) şi tratate cu un agent de deteriorare a ADN-ului ( dreapta). Punctele roz indică proteina XPO-1 care interacţionează cu o proteină care se leagă de ARNm şi le chaperonează din nucleu. Credit: Weill Cornell Medicine.