Pacienţii din România aşteaptă 778 de zile, în medie, pentru a avea acces la un medicament nou autorizat, cel mai mult din Uniunea Europeană, arată ultimul studiu anual WAIT pentru anul 2023, realizat de EFPIA. Faţă de raportul anterior, cu date pentru 2022, când perioada medie de aşteptare era de 918 zile, durata a scăzut sensibil, dar tot rămâne foarte mare în comparaţie cu celelalte state membre ale UE. În schimb, rata de disponibilitate a medicamentelor autorizate deja în UE, adică numărul de medicamente autorizate în ultimii ani la care pacienţii români au acces, este de doar 17%, a treia cea mai mică din blocul comunitar. Datele studiului au fost prezentate joi, în premieră, la o conferinţă organizată de Asociaţia Română a Producătorilor Internaţionali de Medicamente (ARPIM). de către dr. Ioana Bianchi, director pentru Relaţii Externe în cadrul asociaţiei.
În UE, cel mai rapid acces la medicamente este în Germania, unde durează, în medie, 126 de zile între autorizare şi accesul efectiv al pacienţilor la medicament, potrivit studiului. În Italia, durata medie de aşteptare este de 424 zile, în Ungaria - 65a zile, iar în Bulgaria - 728 zile.
Cu toate acestea, rata de disponibilitate a scăzut sensibil în ultimul an, pe fondul reducerii numărului de medicamente introduse pe lista de compensare de către autorităţile din România, pe fondul crizei bugetare din ultimul an.
Astfel, rata de disponibilitate, măsurată prin numărul de medicamente disponibile pentru pacienţi în ţările europene la 5 ianuarie 2024 dintre cele autorizate în perioada 2019-2022, a scăzut la doar 17% în România (de la 30% în raportul de anul trecut), mult sub media europeană.
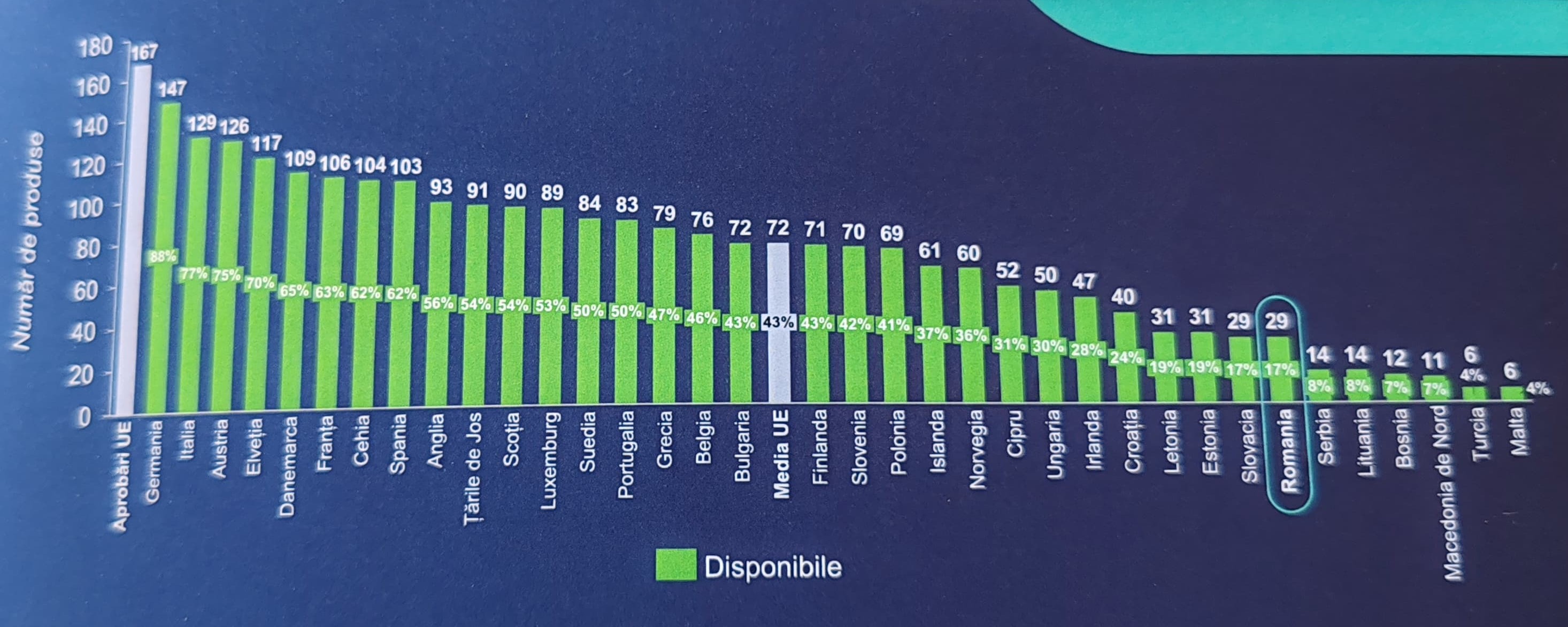
Concret, din 167 de medicamente inovatoare autorizate de Comisia Europeană, la recomandarea Agenţiei Europene a Medicamentului (EMA), în perioada 2019-2022, doar 29 erau disponibile pentru pacienţii români la 5 ianuarie 2024, număr identic cu cel din Slovacia şi mai mare, în UE, doar decât numărul medicamentelor disponibile în Lituania (14) şi Malta (6).
În Bulgaria, dintre cele 167 de medicamente, erau disponibile pentru pacienţi 72 de medicamente, iar în Ungaria - 50, potrivit raportului.
Niciun medicament inovativ autorizat centralizat în UE în 2022 şi 2023 nu este în prezent disponibil pentru pacienţii români.
Totuşi, în ultimul an s-au înregistrat progrese în România, mai ales în privinţa scurtării duratelor de evaluare la Agenţia Naţională a Medicamentului şi a Dispozitivelor Medicale din România (ANMDMR). Problema rămâne la nivelul introducerii medicamentelor pe lista celor compensate, ceea ce înseamnă efectiv acces la pacienţilor la tratament, unde criza bugetară a întârziat compensarea de noi medicamente.
“S-au făcut progrese în ultimii ani în accesul la inovaţie (din 372 de medicamente aprobate la nivel european în perioada 2014-2022, 150 sunt disponibile în România), dar accesul se face la mult timp după ce medicamentele au fost aprobate”, a afirmat dr. Ioana Bianchi.
De asemenea, în cazul contractelor cost-volum se înregistrează probleme în renegocierea contractelor, din cauza fondurilor limitate la nivelul Casei Naţionale de Asigurări de Sănătate (CNAS).
De altfel, din datele Portalului de Acces european, implementat de EFPIA cu ajutorul IQVIA, in care companiile membre EFPIA furnizează informaţii despre depunerea dosarelor de preţuri şi rambursare în toate cele 27 de state membre ale UE, mare parte din durata de la autorizare până la accesul efectiv al pacienţilor este legată de procedurile naţionale.





