Un nou studiu evidenţiază o ţintă pentru terapiile de prevenire a insuficienţei cardiace după un infarct miocardic (atac de cord).
Oamenii de ştiinţă de la Universitatea de Ştiinţe ale sănătăţii California - Los Angeles (UCLA) au identificat proteina GPNMB ca un reglator esenţial în procesul de vindecare a inimii după un infarct.
Folosind modele animale, ei demonstrează într-un studiu recent, că celulele imune derivate din măduva osoasă, numite macrofage, secretă GPNMB, care se leagă de receptorul GPR39, promovând repararea inimii.
Aceste descoperiri oferă o nouă înţelegere a modului în care inima se vindecă singură şi ar putea conduce la noi tratamente menite să îmbunătăţească funcţia inimii şi să prevină evoluţia către insuficienţa cardiacă.
La fiecare 40 de secunde, o persoană din Statele Unite suferă un infarct - principala cauză a insuficienţei cardiace. Aceste evenimente cardiace slăbesc inima şi provoacă cicatrici care reduc capacitatea inimii de a pompa eficient sângele. Şi, deşi acest ţesut cicatricial se formează iniţial pentru a menţine structura inimii, el rămâne permanent, solicitând muşchiul supravieţuitor şi ducând în cele din urmă la insuficienţă cardiacă.
Studiile clinice anterioare au indicat că GPNMB, sau glicoproteina B a melanomului nemetastatic, a fost puternic asociată cu rezultatele cardiovasculare ale persoanelor cu insuficienţă cardiacă. Cu toate acestea, nu era clar dacă lipsa proteinei era direct responsabilă de dezvoltarea insuficienţei cardiace după un infarct. Această distincţie importantă - dacă GPNMB este doar un biomarker asociat sau unul care joacă un rol cauzal - determină dacă proteina poate fi considerată o ţintă terapeutică pentru studiile viitoare.
Utilizând modele de şoareci, cercetătorii au stabilit mai întâi că GPNMB nu este exprimată nativ de inimă, ci este produsă de celulele inflamatorii provenite din măduva osoasă. După un infarct miocardic, aceste macrofage se deplasează la locul leziunii în inimă, unde exprimă GPNMB.
Echipa a efectuat knock-out-uri genetice - inactivarea genei GPNMB - [AS1] şi transplanturi de măduvă osoasă şi a observat că şoarecii lipsiţi de gena GPNMB prezentau rezultate mult mai proaste după un atac de cord, inclusiv o incidenţă mai mare a rupturii inimii, o complicaţie fatală întâlnită şi la pacienţii umani cu insuficienţă cardiacă.
În schimb, şoarecii cu expresie normală a genei GPNMB care au primit o doză suplimentară de proteină GPNMB circulantă au prezentat o îmbunătăţire a funcţiei cardiace şi o reducere a cicatricilor.
La patru săptămâni după un infarct simulat, 67% dintre animalele cărora le lipsea gena GPNMB prezentau fibroză severă sau cicatrici, comparativ cu doar 8% dintre animalele din grupul de control.
În plus faţă de identificarea GPNMB ca moleculă de semnalizare cu efecte în diferite tipuri de celule, cercetătorii au descoperit că aceasta se leagă de GPR39, considerat anterior un receptor orfan sau un receptor al cărui partener de legare nu este cunoscut. Această interacţiune declanşează o cascadă de semnale care promovează regenerarea ţesuturilor şi limitează cicatricile.
Impactul acestei descoperiri
Bolile cardiovasculare şi complicaţiile sale precum insuficienţa cardiacă reprezintă o problemă de sănătate semnificativă, fiind responsabile de aproximativ o treime din totalul deceselor la nivel mondial.
În ciuda prevalenţei sale, nu există tratamente disponibile care să îmbunătăţească în mod direct capacitatea inimii de a se repara după un infarct.
Acest nou studiu demonstrează potenţialul proteinei GPNMB ca agent terapeutic, precum şi GPR39 ca ţintă, care poate limita cicatrizarea, îmbunătăţi funcţia cardiacă şi preveni insuficienţa cardiacă.
Cercetarea ar putea avea, de asemenea, implicaţii mai largi pentru înţelegerea reparării ţesuturilor în alte organe.
Întrucât proteina GPNMB este exprimată în mai multe ţesuturi, studiile viitoare vor explora rolul său în repararea creierului, a rinichilor şi a altor organe afectate de leziuni ischemice.
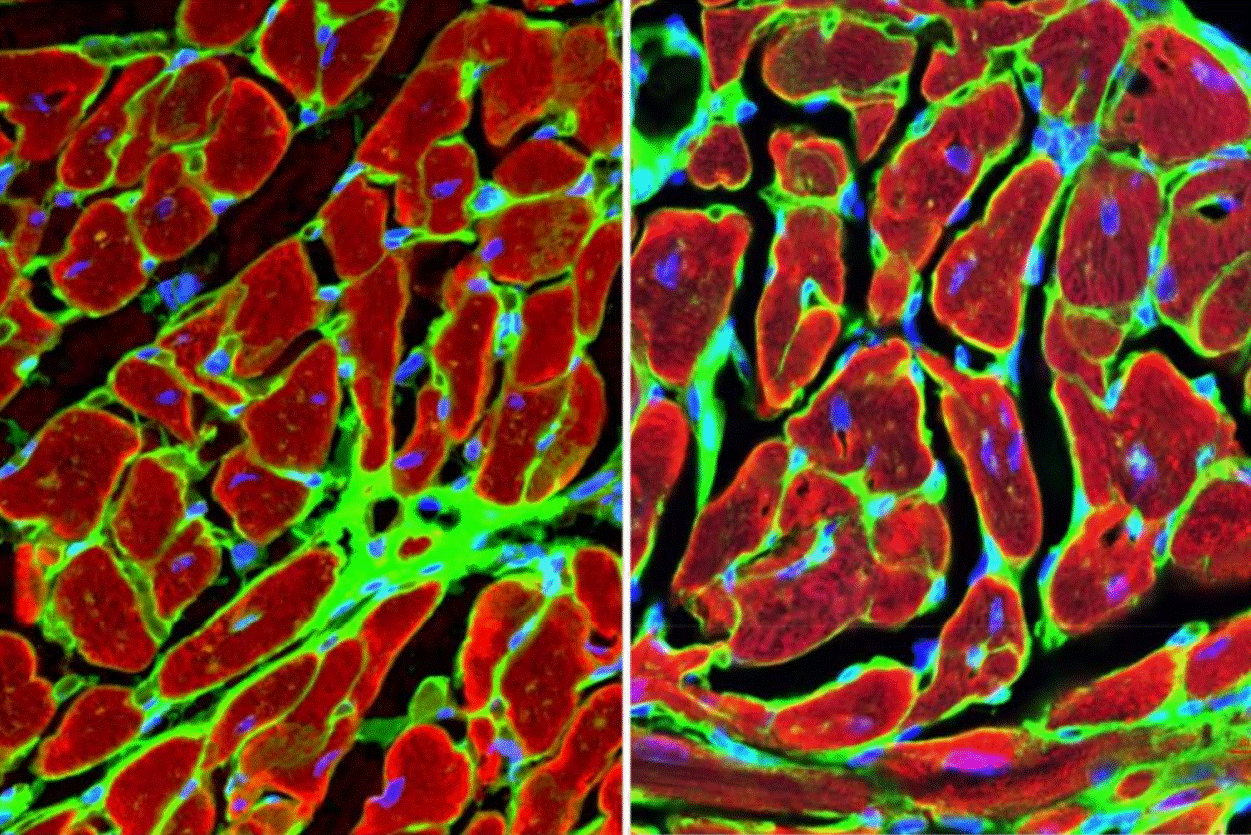
Foto: Celulele muşchiului cardiac care înconjoară ţesutul afectat după un infarct. | Credit: Arjun Deb, Laboratorul UCLA, 25 octombrie 2024