Acumularea de mutaţii în ADN este adesea menţionată ca o explicaţie a procesului de îmbătrânire, dar rămâne doar o ipoteză printre multe altele. O echipă de la Universitatea din Geneva (UNIGE), în colaborare cu Inselspital, Spitalul Universitar din Berna şi Universitatea din Berna (UNIBE), a identificat un mecanism care explică de ce anumite organe, precum ficatul, îmbătrânesc mai rapid decât altele.
Mecanismul relevă faptul că leziunile ADN-ului necodificator*, care sunt deseori ascunse, se acumulează mai mult în ţesuturile cu proliferare lentă, cum ar fi cele ale ficatului sau rinichilor.
Spre deosebire de organele care se regenerează frecvent, aceste leziuni rămân nedetectate pentru o lungă perioadă de timp şi împiedică diviziunea celulară.
Aceste rezultate, publicate marţi în revista Cell, deschid noi căi pentru înţelegerea îmbătrânirii celulare şi, eventual, pentru încetinirea acesteia.
Organele şi ţesuturile umane nu îmbătrânesc toate în acelaşi ritm. Îmbătrânirea, marcată de o creştere a numărului de celule senescente - celule care nu se pot diviza şi care şi-au pierdut funcţiile - afectează ficatul sau rinichii mai rapid decât pielea sau intestinul.
Mecanismele care contribuie la acest proces fac obiectul multor dezbateri în cadrul comunităţii ştiinţifice. Deşi este general acceptat faptul că deteriorarea materialului genetic (ADN), care se acumulează odată cu înaintarea în vârstă, se află la originea îmbătrânirii, legătura dintre cele două fenomene rămâne neclară.
Moleculele de ADN conţin regiuni codificatoare - genele care codifică proteine - şi regiuni necodificatoare care sunt implicate în mecanismele care reglează sau organizează genomul. Deteriorată constant de factori externi şi interni, celula dispune de sisteme de reparare a ADN-ului care împiedică acumularea erorilor.
Erorile localizate în regiunile codificatoare sunt detectate atunci când genele sunt transcrise, adică atunci când sunt activate.
Erorile din regiunile necodificatoare sunt detectate în timpul reînnoirii celulare, care necesită crearea de fiecare dată a unei noi copii a genomului, prin procesul de replicare a ADN-ului. Cu toate acestea, reînnoirea celulară nu are loc cu aceeaşi frecvenţă în funcţie de tipul de ţesut sau de organ.
Ţesuturile şi organele care sunt în contact permanent cu mediul exterior, cum ar fi pielea sau intestinul, îşi reînnoiesc celulele şi, prin urmare, îşi replică ADN-ul mai des - o dată sau de două ori pe săptămână - decât organele interne, cum ar fi ficatul sau rinichii, ale căror celule proliferează doar de câteva ori pe an.
Ficatul, un model ideal pentru studiul îmbătrânirii
Grupul condus de Thanos Halazonetis, profesor titular la departamentul de biologie moleculară şi celulară din cadrul facultăţii de ştiinţe a UNIGE, studiază mecanismele de replicare a ADN-ului. Echipa sa, în colaborare cu grupurile de la Inselspital din Berna şi UNIBE, a studiat celulele hepatice (hepatocite), care proliferează rar.
Oamenii de ştiinţă au analizat legătura potenţială dintre îmbătrânirea mai rapidă a ficatului şi frecvenţa mai scăzută a replicării ADN-ului în celulele acestuia.
„Modelul nostru de studiu, ficatul de şoarece, este un organ ideal pentru studierea mecanismelor de replicare a ADN-ului in vivo. La mamiferele adulte, hepatocitele proliferează rar, cu excepţia cazului în care au fost parţial îndepărtate prin ablaţie. După ablaţia a două treimi din ficatul şoarecilor tineri sau bătrâni, putem studia mecanismele de replicare într-un organ tânăr sau îmbătrânit, direct în organismul viu”, a declarat într-un comunicat prof. Deborah Stroka, una dintre autoarele studiului.
Cartografiind pentru prima dată locurile în care începe replicarea ADN-ului în celulele hepatice care se regenerează după ablaţie, oamenii de ştiinţă au descoperit că acestea sunt întotdeauna situate în regiuni necodificatoare. De asemenea, s-a observat că iniţierea replicării a fost mult mai eficientă la şoarecii tineri decât la şoarecii bătrâni.
„Aceste regiuni necodificatoare nu sunt supuse verificării regulate a erorilor şi, prin urmare, acumulează daune în timp. După îndepărtarea ficatului la şoarecii tineri, există încă puţine daune şi replicarea ADN-ului este posibilă. Dimpotrivă, atunci când experimentul este efectuat la şoarecii bătrâni, numărul excesiv de erori acumulate în timp declanşează un sistem de alarmă care împiedică replicarea ADN-ului”, explică Giacomo Rossetti, cercetător în cadrul departamentului de biologie moleculară şi celulară al facultăţii de ştiinţe a UNIGE şi primul autor al studiului.
Acest blocaj al replicării ADN-ului împiedică celulele să prolifereze, ducând la degradarea funcţiilor celulare şi la senescenţa ţesuturilor.
Speranţe pentru încetinirea procesului de îmbătrânire
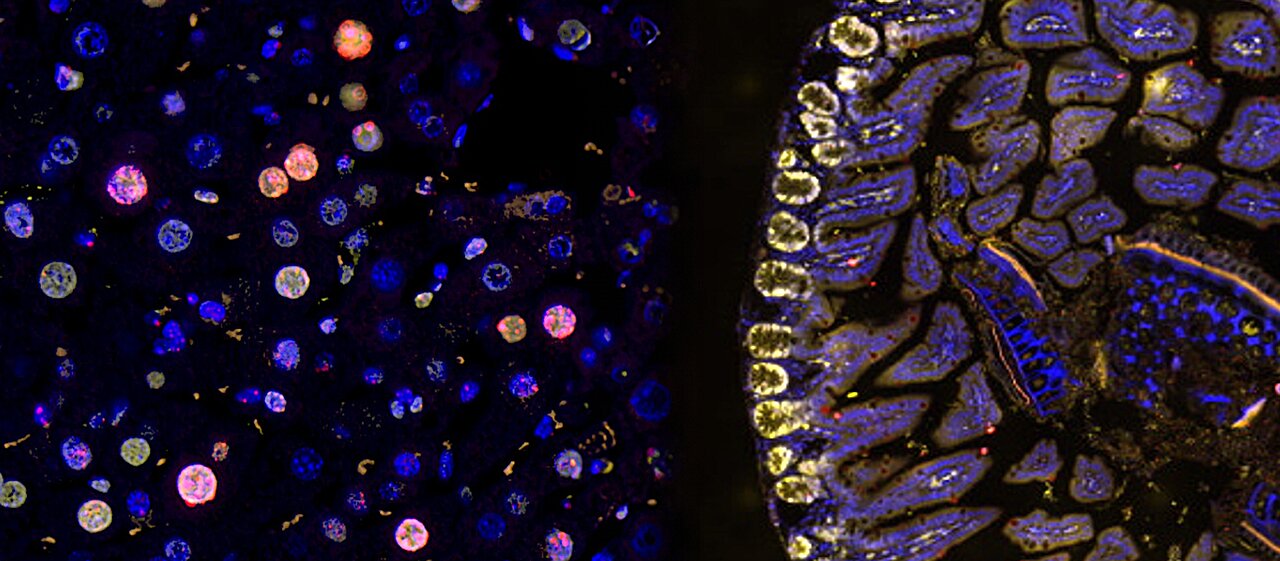
Aceste observaţii ar putea explica de ce ţesuturile cu proliferare lentă, cum ar fi ficatul, îmbătrânesc mai repede decât ţesuturile cu proliferare rapidă, cum este intestinul.
În celulele care au rămas în stare latentă timp îndelungat, prea multe leziuni ale ADN-ului tăcut - secvenţe ADN silenţioase din punct de vedere fenotipic, care nu sunt exprimate în mod normal în timpul ciclului de viaţă al unui individ - s-au acumulat în regiunile necodificatoare, care conţin originile replicării, şi împiedică declanşarea replicării.
Pe de altă parte, în ţesuturile cu proliferare rapidă, se acumulează puţine leziuni datorită reînnoirii frecvente a celulelor, iar originile de replicare îşi păstrează eficienţa.
„Modelul nostru sugerează că, prin repararea leziunilor tăcute ale ADN-ului înainte de declanşarea replicării, ar putea fi evitate anumite aspecte ale îmbătrânirii”, conchide Halazonetis.
Echipa îşi propune să se concentreze pe această nouă ipoteză de lucru în cercetările viitoare.
*Secvenţele de ADN necodificatoare sunt acele părţi din ADN-ul unui organism care nu codifică aminoacizi, adică nu oferă instrucţiuni pentru producerea proteinelor. O parte din ADN necodificator este transcrisă în molecule de ARN necodificator funcţionale (de exemplu, ARN de transfer, ARN ribozomal şi ARN reglator), în timp ce altele nu sunt transcrise sau dau naştere la transcripte de ARN cu funcţie necunoscută. Cantitatea de ADN necodificator variază foarte mult între specii. De exemplu, peste 98% din genomul uman este ADN necodificator, în timp ce doar aproximativ 2% dintr-un genom bacterian tipic este ADN necodificator. Iniţial, o mare parte din ADN necodificator nu avea o funcţie biologică cunoscută. A fost cunoscută sub numele de „junk DNA" sau ADN inutil. Cu toate acestea, se ştie de ani de zile că multe secvenţe necodificatoare sunt funcţionale. Printre acestea se numără genele pentru moleculele funcţionale de ARN şi secvenţe de ADN, cum ar fi semnalele de „început de replicare", centromerii şi telomerii. Alte secvenţe necodificatoare au funcţii probabile, dar încă nedescoperite. Acest lucru este dedus din nivelurile ridicate de similaritate a secvenţelor observate în diferite specii de ADN. Proiectul Enciclopedia elementelor ADN (ENCODE) a sugerat în septembrie 2012 că peste 80% din ADN-ul din genomul uman „are un anumit scop, din punct de vedere biochimic". Această concluzie a fost puternic criticată de alţi oameni de ştiinţă.
Imagine: Celulele hepatice cu ADN deteriorat sunt colorate în roşu (stânga). Celulele intestinale proliferante, fără leziuni ale ADN-ului, sunt colorate în galben (dreapta). Credit: UNIGE - UNIBE, septembrie 2024.