Se estimează că maladia Alzheimer este cauza demenţei pentru mai mult de 32 de milioane de persoane din întreaga lume şi încă nu există în prezent niciun tratament pentru vindecarea ei. Majoritatea oamenilor de ştiinţă consideră că boala Alzheimer apare ca urmare a modificărilor din creier cauzate de acumulările anormale de proteine amiloide şi tau. O echipă internaţională de cercetători a efectuat un studiu bazat pe o nouă terapie genică pentru Alzheimer menită să reducă nivelul proteinelor tau din creier.
Deşi oamenii de ştiinţă nu sunt încă complet siguri de cauzele bolii Alzheimer, cea mai populară teorie este că aceasta apare atunci când acumulările anormale a două proteine, amiloid şi tau, provoacă modificări în creier.
În timp ce medicii pot trata simptomele maladiei Alzheimer pentru a îmbunătăţi calitatea vieţii unei persoane, nu există încă niciun tratament vindecător pentru această boală care se estimează că afectează 32 de milioane de persoane din întreaga lume.
În prezent, o echipă internaţională de cercetători a efectuat un studiu folosind o nouă terapie de reducere la tăcere a genelor pentru a trata boala Alzheimer.
Terapia reduce la tăcere gena care codifică proteina tau, scăzând cantitatea de proteină creată în organism.
Acest studiu a fost publicat în urmă cu o săptămână, în revista Nature Medicine.
Cum afectează proteina tau boala Alzheimer?
Tau este o proteină care se găseşte cel mai frecvent în neuroni, celulele centrale ale sistemului nervos. Într-un creier sănătos, tau ajută la stabilizarea structurii interne tubulare a celulelor nervoase.
Aceste structuri tubulare, cunoscute sub numele de microtubuli, ajută la menţinerea formei celulei şi se asigură că alte proteine şi molecule călătoresc cu uşurinţă prin întregul neuron.
Într-un creier cu boala Alzheimer, proteina tau se detaşează de microtubuli şi se ataşează în schimb de alte proteine tau din interiorul celulei cerebrale. Acest lucru determină acumulări anormale de proteine tau şi colapsul microtubulilor.
Aceste acumulări de proteină tau se unesc pentru a forma „ghemuri (încurcături) neurofibrilare" în celulele creierului. Când se întâmplă acest lucru, neuronii nu mai pot comunica între ei.
„Ştim că ghemurile tau urmăresc progresia bolii Alzheimer, ceea ce înseamnă că, cu cât boala se agravează, cu atât mai multe încurcături tau există în tot mai multe părţi din creier", a declarat pentru un jurnal american de sănătate dr. David Merrill, psihiatru pentru adulţi şi geriatrie şi director al Pacific Neuroscience Institute's Pacific Brain Health Center din cadrul Providence Saint John's Health Center din Santa Monica, California, care nu este implicat în această cercetare.
„Iar acestea determină în cele din urmă disfuncţionalitatea şi moartea neuronilor", a explicat el.
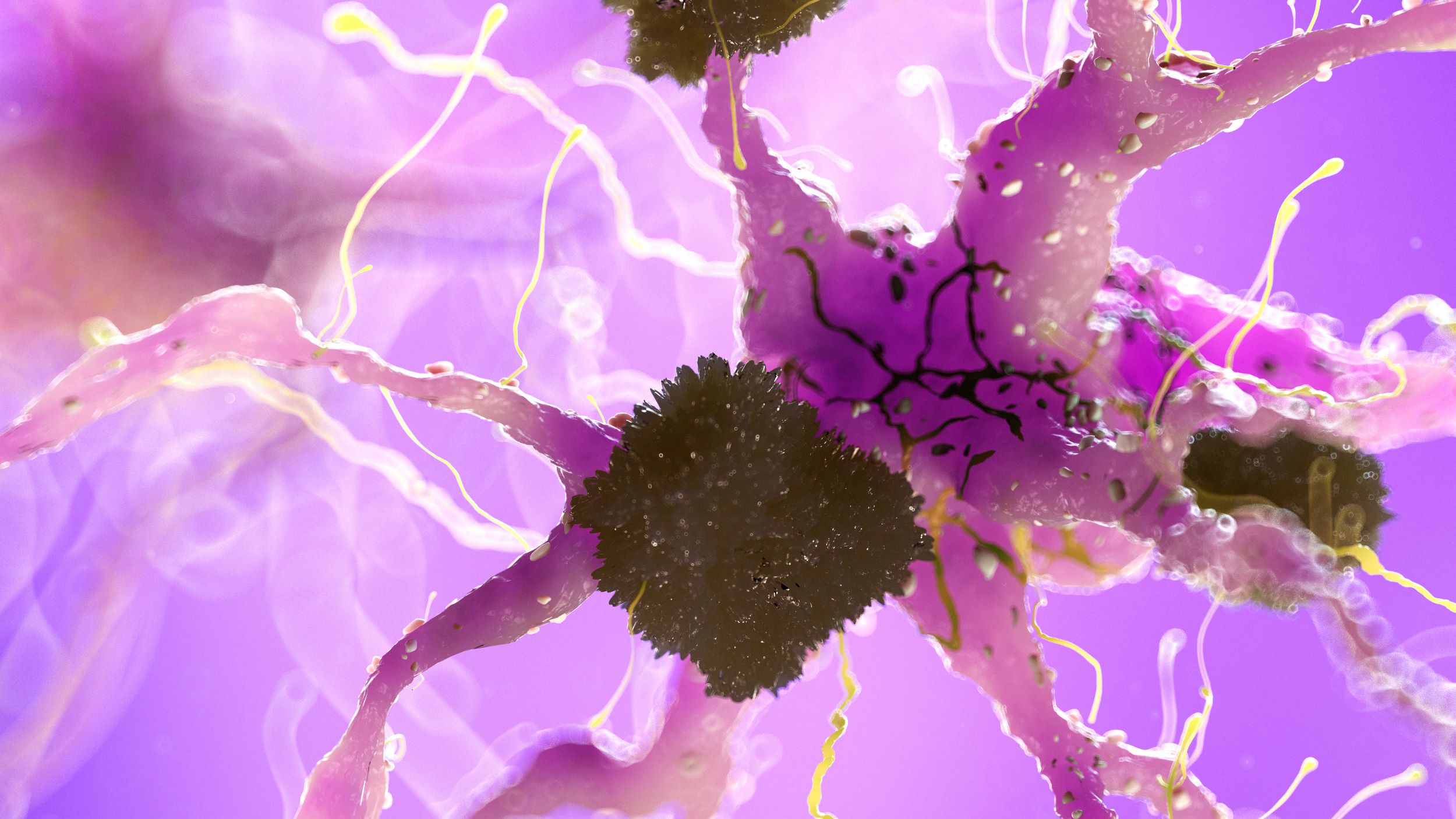 Foto: acumulări de proteine beta-amiloid (β-amiloid) în neuroni
Foto: acumulări de proteine beta-amiloid (β-amiloid) în neuroni
Reducerea la tăcere a genei care codifică tau
În acest studiu, cercetătorii au creat un medicament care vizează reducerea la tăcere a genei care codifică proteina tau. Acea genă este gena pentru microtubuli-asociată cu proteina tau (MAPT).
Medicamentul experimental, numit BIIB080, este un oligonucleotid antisens. Acest tip de terapie funcţionează prin utilizarea unor bucăţi mici de ARN sau ADN pentru a bloca un anumit ARN să facă ceea ce ar trebui să facă. În acest caz, acela de a servi drept instrucţiuni pentru producerea proteinei tau.
În acest studiu clinic de fază 1, oamenii de ştiinţă au înrolat 46 de pacienţi cu boala Alzheimer uşoară, cu o vârstă medie de 66 de ani. Studiul a avut loc în perioada 2017-2020.
Studiul a comparat patru doze de medicament experimental administrate prin injectare în sistemul nervos prin canalul spinal, comparativ cu un placebo, la fiecare 4 sau 12 săptămâni, pe parcursul unui tratament de 13 săptămâni.
La încheierea studiului, cercetătorii au constatat că participanţii din grupurile de tratament care au primit cea mai mare doză de medicament au înregistrat o reducere cu peste 50% a nivelurilor de concentraţie atât a concentraţiei totale de tau, cât şi a concentraţiei de tau fosforilat la 24 de săptămâni după tratament.
Cercetătorii au raportat efecte secundare uşoare sau moderate la 94% dintre participanţii care au primit medicamentul şi la 75% dintre participanţii care au primit placebo, iar peste 90% dintre aceştia au finalizat perioada de după tratament. Durerile de cap după injectarea medicamentului experimental au fost cel mai frecvent efect secundar.
O abordare terapeutică „plauzibilă"
Potrivit specialiştilor din domeniu este „uimitor" faptul că cercetătorii au reuşit să reducă la tăcere expresia genei care creează ghemurile tau în creierul bolnav de Alzheimer.
„Acesta este primul pas pentru a arăta că bordarea este una sigură, şi are un mecanism biologic plauzibil, care poate fi apoi testat pentru a vedea dacă într-adevăr face ceea ce ne-am aştepta, adică să încetinească progresia bolii Alzheimer şi să fie o terapie de modificare a bolii care are ca rezultat îmbunătăţirea cogniţiei oamenilor pentru mai mult timp", a declarat dr. David Merrill.
Dr. Raphi Wald, un neuropsiholog certificat la Marcus Neuroscience Institute, din Florida, neimplicat în această cercetare, a comentat rezultatele că fiind un pas pozitiv în direcţia corectă.
„În prezent, se desfăşoară numeroase cercetări privind prevenirea sau distrugerea proteinelor anormale care apar în creierul persoanelor cu boala Alzheimer, iar acest lucru adaugă o nouă abordare la această cercetare", a declarat el.
Potrivit medicului, creierele persoanelor cu boala Alzheimer tind să prezinte niveluri mai ridicate de două proteine, tau şi amiloid, decât cele ale persoanelor care nu suferă de Alzheimer. Cercetarea în domeniul Alzheimer s-a concentrat în mare măsură pe controlul răspândirii acestor patologii în creier, iar acest studiupropune ceea ce ar putea fi o metodă eficientă de a face acest lucru, a menţionat medicul.
Dr. Claire Sexton, director senior al programelor ştiinţifice şi de informare la Asociaţia Alzheimer, a comentat rezultatele studiului.
„În timp ce terapiile anti-amiloid pentru boala Alzheimer au atras o mare parte din lumina reflectoarelor, peisajul dezvoltării medicamentelor este mult mai larg, cu diverse ţinte şi abordări în curs de investigare", a comentat ea.
„Acesta este un raport binevenit al unui studiu de fază 1 care utilizează o abordare de reducere la tăcere a genelor pentru a viza tau, una dintre caracteristicile cheie ale bolii Alzheimer", a precizat medicul.
Ce urmează pentru cercetarea şi tratamentul bolii Alzheimer?
Când vine vorba de următorii paşi în această cercetare, dr. Wald crede că ceea ce este cel mai important cu aceste tratamente este modul în care afectează viaţa de zi cu zi a persoanelor predispuse sau care trăiesc cu Alzheimer.
„Reducerea proteinelor tau nu este o garanţie că oamenii nu vor continua să aibă o înrăutăţire a funcţionării cognitive", a avertizat el.
Dr. Merrill a spus că evoluţia naturală ar fi un studiu de fază 2 pentru siguranţă şi tolerabilitate în ceea ce priveşte efectele secundare.
„Şi apoi, studiul definitiv de fază 3 ar fi pentru a analiza cu adevărat eficacitatea tratamentului", a continuat el.
„Se îmbunătăţeşte memoria? Înrăutăţirea memoriei încetineşte în timp la pacienţii cu boala Alzheimer? Mi-ar plăcea să văd acest medicament studiat în studii clinice în etape ulterioare pentru a vedea dacă ajută sau nu performanţa memoriei sau dacă păstrează performanţa memoriei în cazul bolii Alzheimer", a precizat el.
Dr. Sexton a subliniat că, întrucât toţi participanţii la studiu au fost de culoare albă, vor fi necesare mai multe cercetări care să includă populaţii diverse pentru a examina pe deplin siguranţa, implicarea ţintelor şi beneficiile clinice la toate populaţiile.
„Cu toate acestea, având în vedere rolul tau nu numai în Alzheimer, ci şi în alte demenţe, cunoscute sub numele de taupatii, aceste rezultate reprezintă o evoluţie semnificativă şi un motiv în plus de optimism în domeniu", a adăugat ea.
Dincolo de amiloid şi tau: Noi ţinte în dezvoltarea tratamentelor pentru demenţă
Boala Alzheimer este cea mai frecventă formă de demenţă. Deşi nu se cunoaşte cauza exactă a acesteia, timp de mulţi ani oamenii de ştiinţă au crezut că o proteină numită beta-amiloid este responsabilă. Recent, această ipoteză a amiloidului a fost pusă la îndoială şi a avut loc o creştere uriaşă a cercetării în domeniul demenţei.
În continuare, cele mai recente descoperiri, şi posibilele progrese în domeniul diagnosticării.
Există mai multe forme de demenţă, dintre care boala Alzheimer este cea mai frecventă. Potrivit Organizaţiei Mondiale a Sănătăţii (OMS), în prezent există 55 de milioane de persoane în întreaga lume care suferă de demenţă, iar dintre acestea între 30 şi 40 de milioane sunt susceptibile de a avea Alzheimer.
Având în vedere îmbătrânirea populaţiei din întreaga lume, numărul persoanelor cu demenţă este în creştere rapidă. Asociaţia Alzheimer estimează că 6,7 milioane de persoane din Statele Unite au boala Alzheimer, dar până în 2050, se preconizează că acest număr aproape se va dubla, ajungând la 12,7 milioane, numai în această ţară.
Deşi Alzheimer este cea mai frecventă formă de demenţă, cauza exactă a acesteia încă scapă cercetătorilor. Timp de mai mulţi ani, majoritatea au considerat ipoteza beta-amiloidului ca fiind cea mai probabilă explicaţie, dar recent, aceasta a fost pusă sub semnul întrebării.
Aşadar, este beta-amiloidul cauza bolii Alzheimer sau există şi alte modificări care ar putea duce la această boală care este a şaptea cea mai frecventă cauză de deces la nivel mondial? Această întrebare a fost subiectul multor cercetări recente.
Beta-amiloid şi tau
Beta-amiloidul este o peptidă formată dintr-o proteină mai mare, numită proteină precursoare amiloidă (PPA).
PPA este o glicoproteină membranară de tip 1 care este implicată în dezvoltarea şi funcţionarea celulelor nervoase, în semnalizarea şi transportul în interiorul celulelor.
Atunci când enzimele taie PPA în molecule mai mici, monomerii beta-amiloid sunt unul dintre produse.
Aceşti monomeri sunt susceptibili de a fi importanţi în menţinerea sănătăţii celulelor nervoase. Problemele apar atunci când beta-amiloidul se agreghează în fibrile şi plăci, despre care mulţi cercetători cred că joacă un rol important în dezvoltarea bolii Alzheimer.
Ipoteza cascadei amiloide, propusă pentru prima dată în 1992, a sugerat că plăcile amiloide sunt prima etapă în dezvoltarea Alzheimer, care duce la încurcături neurofibrilare (încurcături tau), pierderea celulelor, leziuni vasculare şi demenţă.
Tau este o proteină care ajută la stabilizarea scheletului intern al celulelor nervoase. În boala Alzheimer se acumulează o formă anormală de tau, perturbând scheletul intern şi formând încurcăturile neurofibrilare. Aceste încurcături încetinesc capacitatea unei persoane de a gândi şi de a-şi aminti lucruri.
„Este larg recunoscut faptul că simptomele cognitive datorate bolii Alzheimer se corelează cel mai bine cu răspândirea previzibilă a proteinei tau în creier", spune dr. Emer MacSweeney, director executiv şi neuroradiolog consultant la Re:Cognition Health
Punerea sub semnul întrebării a ipotezei amiloidului
Deşi această ipoteză este familiară şi a concentrat eforturile de cercetare în numeroase studii şi cercetări pentru dezvoltarea unor tratamente ţintă, cercetătorii au început să se întrebe dacă ipoteza cascadei amiloide este cea mai bună explicaţie pentru dezvoltarea bolii Alzheimer.
S-a demonstrat că noile medicamente care vizează acumularea de beta-amiloid elimină plăcile amiloide, dar niciunul nu a reuşit încă să inverseze simptomele bolii Alzheimer. Cu toate acestea, există unele dovezi că acestea ar putea încetini declinul cognitiv, după cum a declarat dr. MacSweeney pentru Medical News Today.
„Autorizarea de către Administraţia americană de reglementare pentru alimente şi medicamente (FDA) a lecanemab, în luna ianuarie a acestui an, a confirmat o corelaţie între îndepărtarea proteinei amiloide din creier şi încetinirea progresiei declinului cognitiv la persoanele cu deficienţă cognitivă uşoară (MCI) şi demenţă uşoară datorată bolii Alzheimer", a precizat ea.
Cu toate acestea, relaţia dintre amiloid şi Alzheimer nu este în întregime clară. Deşi pare să existe o corelaţie între plăci şi demenţă, multe persoane care nu au prezentat semne de demenţă prezintă o patologie amiloidă semnificativă la examinarea post-mortem.
Recent, într-o altă lovitură dată acestei ipoteze, oamenii de ştiinţă au pus sub semnul întrebării veridicitatea imaginilor dintr-o lucrare din 2006, despre care se credea că oferă dovezi solide pentru această teorie. Această lucrare, publicată în Nature, a arătat că atunci când şobolanii tineri au fost injectaţi cu un anumit beta-amiloid, beta-amiloid-56, aceştia au dezvoltat deficite de memorie.
Deşi lucrarea a fost citată de peste 2.000 de ori, după ce s-a sugerat că imaginile ar fi putut fi manipulate, concluziile lucrării sunt acum contestate.
Cu toate acestea, dr. MacSweeney consideră că ar trebui să se lucreze în continuare la medicamente care vizează beta-amiloidul.
„Multe tratamente noi în curs de dezvoltare, în prezent, continuă să se concentreze pe proteina amiloidă toxică şi este probabil că vor apărea pe piaţă medicamente care să ofere o reducere şi mai eficientă a ratei de declin cognitiv decât lecanemab".
Poate că beta-amiloidul este o parte a explicaţiei, dar pare mai puţin probabil ca acesta să poată explica pe deplin dezvoltarea bolii Alzheimer.
Ce se mai află în curs de cercetare în Alzheimer?
Un studiu recent a întărit dovezile privind implicarea beta-amiloidului, dar a propus un mecanism de acţiune diferit.
Constatările sale au sugerat că beta-amiloidul determină două proteine să se lege între ele, activând genele care stimulează apoi acumularea de tau. Cercetătorii au identificat un medicament care ar putea întrerupe acest proces, sugerând o posibilă cale de tratament.
Un alt studiu a sugerat că declinul cognitiv ar putea fi declanşat de disfuncţia astrocitelor - celule gliale care alcătuiesc majoritatea celulelor din sistemul nervos central uman (SNC) şi care ajută la menţinerea unui mediu corect pentru celulele nervoase. Studiul sugerează că activitatea imunitară anormală a astrocitelor ar putea cauza deficite cognitive în demenţă.
De asemenea, în sprijinul implicării astrocitelor se află un alt studiu, din Coreea de Sud, care sugerează că astrocitele reactive absorb excesiv de mult acetat în modelele de boală Alzheimer şi că această absorbţie ridicată este asociată cu reducerea funcţiei cognitive.
Un alt studiu a indicat posibilitatea ca Alzheimer să fie o boală autoimună.
Factori de risc şi factori de stres pentru sănătate în cazul bolii Alzheimer
Pe măsură ce continuă cursa pentru dezvoltarea unor tratamente pentru boala Alzheimer, un alt obiectiv-cheie al cercetării îl reprezintă identificarea factorilor care cresc riscul unei persoane, astfel încât aceştia să poată fi abordaţi pentru a se reduce acest risc.
„Este esenţial ca medicii care se ocupă de adulţii de vârstă mijlocie şi vârstnici să privească atât dincolo, cât şi înainte de depunerea de amiloid şi tau în creier. Acum cunoaştem literalmente zeci de factori de stres pentru sănătate care duc la demenţe neurodegenerative", a declarat dr. David Merrill, psihiatru pentru adulţi şi geriatrie şi director al Pacific Neuroscience Institute's Pacific Brain Health Center din cadrul Providence Saint John's Health Center din Santa Monica, California.
Femeile sunt de mai mult de două ori mai afectate de boala Alzheimer decât bărbaţi şi, deşi acest lucru a fost adesea explicat prin longevitatea mai mare a femeilor, cercetătorii au investigat, de asemenea, dacă hormonii pot afecta riscul de apariţie al bolii.
Un nou studiu a descoperit că menopauza precoce este asociată cu niveluri ridicate de tau în creier, în special la femeile care întârzie începerea terapiei hormonale (HRT).
Întrucât cele din acest studiu cu menopauză mai târzie sau cu un început mai devreme al HRT nu au avut aceeaşi creştere a nivelului de tau, acest lucru ar putea sugera că estrogenul are un efect protector împotriva bolii Alzheimer.
Dar ar putea exista şi alte explicaţii pentru prevalenţa mai mare a bolii Alzheimer la femei - varianta genei APOE e4, care creşte riscul de demenţă şi este purtată de aproximativ 15% până la 25% dintre persoane, pare să aibă mai mult efect la femei decât la bărbaţi.
Alte studii au sugerat că unele medicamente, cum ar fi cele utilizate pentru somn ar putea reduce acumularea de aglomerări toxice de proteine în lichidul cefalorahidian, responsabil de igiena creierul în fiecare noapte, iar infecţiile microbiene frecvente şi virusurile au fost asociate cu un risc crescut de boală Alzheimer.
„Înţelegerea acestei boli, care este probabil să nu fie o singură entitate de boală, devine din ce în ce mai sofisticată, cu mai mulţi biomarkeri de diagnosticare şi numeroase tipuri noi de tratamente potenţiale, care vizează multe componente diferite ale etiologiei bolii", a comentat dr. MacSweeney, explicând faptul că există încă multe căi de investigat.
„Aceste noi direcţii de cercetare includ [un] accent pe potenţiale noi tratamente care implică mecanisme epigenetice, neuroinflamatorii şi imunomediate", a adăugat ea.
Evoluţii recente în domeniul diagnosticării
O modalitate de a contribui la încetinirea progresului bolii Alzheimer este diagnosticarea timpurie a afecţiunii, astfel încât expunerea la factorii de risc comuni să poată fi modificată.
Diagnosticul timpuriu înseamnă, de asemenea, că se poate începe un tratament pentru a ajuta la gestionarea simptomelor. Şi s-au înregistrat multe progrese în căutarea unor metode rapide şi mai puţin invazive de a diagnostica mai devreme boala Alzheimer.
Studii recente au identificat mai mulţi biomarkeri în sânge care pot indica boala Alzheimer.
Un studiu a descoperit o legătură între nivelurile unei molecule de zahăr, glicanul, din sânge şi tau, ceea ce ar putea prezice boala Alzheimer cu până la 10 ani înainte de apariţia simptomelor.
Un altul a identificat tau fosforilat ca fiind un posibil predictor. Un alt studiu, care a descoperit modificări semnificative în retina persoanelor care au murit cu boala Alzheimer, sugerează că depistarea retinei ar putea fi o metodă neinvazivă de detectare a stadiilor incipiente ale bolii Alzheimer.
Noi tratamente potenţiale
Pe lângă noile medicamente care vizează plăcile amiloide, alte terapii aflate în curs de investigare se arată promiţătoare.
Într-un studiu efectuat pe şoareci, cercetătorii au identificat că celulele nervoase din corpii mamilari au fost deosebit de sensibile la neurodegenerare şi au putut inversa tulburările de memorie rezultate prin tratarea acestora cu un medicament care este utilizat în prezent pentru tratarea epilepsiei.
Specialiştii sunt de acord că merită să fie cercetaţi în continuare corpii mamilari.
„Constatări similare au fost elucidate la om, iar laboratorul TSAI (de la MIT) lucrează acum la definirea mai amănunţită a modului în care neuronii laterali ai corpului mamilar sunt conectaţi la alte părţi ale creierului, pentru a ne da seama cum se formează circuitele de memorie şi cum să concepem apoi noi tratamente foarte bine ţintite pentru boala Alzheimer, pentru a preveni progresia simptomelor şi, în mod ideal, pentru a preveni apariţia simptomelor în primul rând", a comentat dr. MacSweeney.
Această zonă a creierului a fost, de asemenea, în centrul cercetărilor privind stimularea profundă a creierului pentru ameliorarea simptomelor bolii Alzheimer.
Deşi acest tratament implică, în general, introducerea de electrozi în creier, o nouă metodă neinvazivă numită chimiogenetică s-a dovedit a fi promiţătoare într-un model de şoarece, ceea ce a provocat apeluri pentru continuarea cercetărilor privind potenţialul acesteia.
Una dintre direcţiile de cercetare include identificarea unor ţinte medicamentoase care ar putea imita efectele sale benefice la persoanele cu boala Alzheimer.
Molecula ARNm ar putea fi o altă ţintă în combaterea bolii Alzheimer. Un studiu din China a constatat recent că modificarea ARNm la şoareci a contribuit la îmbunătăţirea simptomelor cognitive ale bolii Alzheimer.
Perspectivele bolii Alzheimer
„Demenţa poate fi rezolvată, dar nu va fi prin abordarea unui singur factor de sănătate. Trebuie să nu lăsăm nicio piatră neîntoarsă pentru fiecare individ cu risc de Alzheimer, optimizând factorii suboptimi pe tot parcursul vieţii şi până la bătrâneţe. Acest lucru ne oferă fiecăruia dintre noi cele mai bune şanse de a ajunge la o îmbătrânire reuşită, fără dizabilităţi cronice asociate cu Alzheimer şi alte demenţe neurodegenerative", spune dr. David Merrill.
Este posibil să nu existe încă un tratament vindecător pentru boala Alzheimer, dar, odată cu renaşterea eforturilor de cercetare axate pe această afecţiune, perspectivele vor deveni probabil mai bune pentru numeroasele persoane afectate de această maladie debilitantă.





